题目内容
周期表中短周期6种元素A、B、C、D、E、F,原子序数依次增大.A的原子半径最小,A和D、C和F分别同主族,F的单质是黄色固体,B所形成的化合物种类最多,E的最外层电子数等于其电子层数.
(1)写出工业制备E单质的化学方程式 .
(2)写出一种由其中两种元素组成的既含极性键又含非极性键的18电子微粒 (写化学式).
(3)由A、C元素组成的化合物甲与由D、C元素组成的化合物乙反应可制备O2,请写出乙的电子式 .
(4)3mol DABC3和2mol D2C2混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分及物质的量分别是 .
(1)写出工业制备E单质的化学方程式
(2)写出一种由其中两种元素组成的既含极性键又含非极性键的18电子微粒
(3)由A、C元素组成的化合物甲与由D、C元素组成的化合物乙反应可制备O2,请写出乙的电子式
(4)3mol DABC3和2mol D2C2混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分及物质的量分别是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:短周期6种元素A、B、C、D、E、F,原子序数依次增大.A的原子半径最小,所以A是H,A和D同主族,D是Na,F的单质是黄色固体,F是S,C和F同主族,所以C是O,B所形成的化合物种类最多,即为C,E的最外层电子数等于其电子层数,即为Al.
(1)工业上电解熔融的氧化铝来制取金属铝;
(2)根据18电子微粒的种类以及极性键、非极性键的概念来回答;
(3)过氧化钠可以和水之间反应生成氢氧化钠和氧气;
(4)加热时,发生反应如下:2NaHCO3
Na2CO3 +H2O+CO2↑,2Na2Oz+2CO2═2Na2CO3+O2,2Na2Oz+2H2O═4NaOH+O2↑,结合反应的化学方程式和反应物的物质的量判断反应产物.
(1)工业上电解熔融的氧化铝来制取金属铝;
(2)根据18电子微粒的种类以及极性键、非极性键的概念来回答;
(3)过氧化钠可以和水之间反应生成氢氧化钠和氧气;
(4)加热时,发生反应如下:2NaHCO3
| ||
解答:
解:短周期6种元素A、B、C、D、E、F,原子序数依次增大.A的原子半径最小,所以A是H,A和D同主族,D是Na,F的单质是黄色固体,F是S,C和F同主族,所以C是O,B所形成的化合物种类最多,即B为C,E的最外层电子数等于其电子层数,即E为Al.
(1)工业上电解熔融的氧化铝来制取金属铝,反应方程式为:Al2O3
4Al+3O2↑,故答案为:Al2O3
4Al+3O2↑;
(2)H2O2是两种元素组成的既含极性键又含非极性键的18电子微粒,故答案为:H2O2;
(3)由H、O元素组成的化合物甲H2O与由Na、O元素组成的化合物乙:Na2O2反应可制备O2,过氧化钠是含有离子键和共价键的离子化合物,电子式为: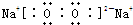 ,故答案为:
,故答案为: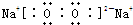 ;
;
(4)3molNaHCO3和2molNa2O2混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,加热后,发生反应如下:
2NaHCO3
Na2CO3 +H2O+CO2↑,
3mol 1.5mol 1.5mol 1.5mol
2Na2O2+2CO2═2Na2CO3+O2
1mol 1mol 1mol
2Na2O2+2H2O═4NaOH+O2↑
1mol 1mol 2mol
n(Na2CO3)=1mol+1.5mol=2.5mol,n(NaOH)=2mol,所以容器内残留物的成分及物质的量分别是n(Na2CO3)=2.5mol,n(NaOH)=2mol,
故答案为:n(Na2CO3)=2.5mol,n(NaOH)=2mol.
(1)工业上电解熔融的氧化铝来制取金属铝,反应方程式为:Al2O3
| ||
| ||
(2)H2O2是两种元素组成的既含极性键又含非极性键的18电子微粒,故答案为:H2O2;
(3)由H、O元素组成的化合物甲H2O与由Na、O元素组成的化合物乙:Na2O2反应可制备O2,过氧化钠是含有离子键和共价键的离子化合物,电子式为:
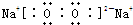 ,故答案为:
,故答案为: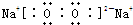 ;
;(4)3molNaHCO3和2molNa2O2混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,加热后,发生反应如下:
2NaHCO3
| ||
3mol 1.5mol 1.5mol 1.5mol
2Na2O2+2CO2═2Na2CO3+O2
1mol 1mol 1mol
2Na2O2+2H2O═4NaOH+O2↑
1mol 1mol 2mol
n(Na2CO3)=1mol+1.5mol=2.5mol,n(NaOH)=2mol,所以容器内残留物的成分及物质的量分别是n(Na2CO3)=2.5mol,n(NaOH)=2mol,
故答案为:n(Na2CO3)=2.5mol,n(NaOH)=2mol.
点评:本题考查元素周期表和原子结构知识,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意元素的推导是很关键的.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
下列各组离子一定能够大量共存的是( )
| A、Na+、Mg2+、SO42-、NO3- |
| B、Fe2+、H+、SO42-、NO3- |
| C、K+、Al3+、Cl-、AlO2- |
| D、Na+、Ca2+、OH-、HCO3- |
设NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、1.7 g NH3中含有的电子数为NA |
| B、22.4 L H2中含有的氢分子数为NA |
| C、标准状况下,22.4 L水中含有的原子数为3NA |
| D、1 L 2 mol/L Na2SO4溶液中含有的钠离子数为2NA |
一定温度下的密闭容器中,反应2SO2(g)+O2(g)?2SO3(g)达到平衡.缩小容器容积,对反应产生影响的叙述不正确的是( )
| A、使平衡常数K增大 |
| B、使平衡向正反应方向移动 |
| C、使SO3的浓度增大 |
| D、使正反应速率大于逆反应速率 |

 已知:A、F为金属单质,D、E为气态单质,其余均为化合物,其中C的焰色反应呈黄色;B为黑色粉末,J为蓝色沉淀.各物质间的转化关系如图所示(部分生成物已略去):
已知:A、F为金属单质,D、E为气态单质,其余均为化合物,其中C的焰色反应呈黄色;B为黑色粉末,J为蓝色沉淀.各物质间的转化关系如图所示(部分生成物已略去): 控制适宜条件,将反应2Fe3++2I-?2Fe2++I2,
控制适宜条件,将反应2Fe3++2I-?2Fe2++I2,