题目内容
已知Mg能在CO2气体中燃烧(CO2+2Mg
2MgO+C).若将6g镁粉在下列不同条件下点燃.
求:(1)在足量CO2气体中,反应结束后所得固体的质量.
(2)在CO2和O2的混合气体中,反应后O2有剩余,则最终固体的质量为 克.
| ||
求:(1)在足量CO2气体中,反应结束后所得固体的质量.
(2)在CO2和O2的混合气体中,反应后O2有剩余,则最终固体的质量为
考点:化学方程式的有关计算
专题:计算题
分析:(1)反应结束所得固体为MgO、C,根据n=
计算Mg的物质的量,根据方程式计算MgO、C物质的量,再根据m=nM计算;
(2)Mg在CO2和O2的混合气体中,反应后O2有剩余,实际发生反应2Mg+O2
2MgO,最终固体为MgO,根据方程式计算生成MgO的质量.
| m |
| M |
(2)Mg在CO2和O2的混合气体中,反应后O2有剩余,实际发生反应2Mg+O2
| ||
解答:
解:(1)n(Mg)=6 g÷24 g?mol-1=0.25 mol,
CO2+2Mg
2MgO+C
2 2 1
0.25mol 0.25mol 0.125mol
m(MgO)=0.25 mol×40 g?mol-1=10 g
m(C)=0.125 mol×12 g?mol-1=1.5 g
固体总质量:10 g+1.5 g=11.5 g
故答案为:11.5g;
(2)Mg在CO2和O2的混合气体中,反应后O2有剩余,最终生成MgO,令生成氧化镁的质量为a,则:
2Mg+O2
2MgO
48 80
6g a
所以,48:80=6g:a,解得a=10g
故答案为:10.
CO2+2Mg
| ||
2 2 1
0.25mol 0.25mol 0.125mol
m(MgO)=0.25 mol×40 g?mol-1=10 g
m(C)=0.125 mol×12 g?mol-1=1.5 g
固体总质量:10 g+1.5 g=11.5 g
故答案为:11.5g;
(2)Mg在CO2和O2的混合气体中,反应后O2有剩余,最终生成MgO,令生成氧化镁的质量为a,则:
2Mg+O2
| ||
48 80
6g a
所以,48:80=6g:a,解得a=10g
故答案为:10.
点评:本题考查根据方程式进行计算,难度不大,(2)注意判断发生的反应是关键.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、碳酸氢钠的电离:NaHCO3=Na++HCO3- |
| B、将金属钠加入水中:Na+2H2O=Na++2OH-+H2↑ |
| C、硫化钠水解:S2-+2H2O=H2S↑+2OH- |
| D、向氯化铝溶液中加入过量的氨水:Al3++4OH-=Al(OH )4- |
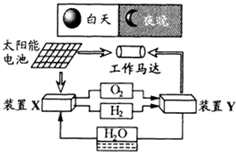 如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )| A、二氧化硅是太阳能电池的光电转换材料 |
| B、装置Y中正极的电极反应式为:O2+2H2O+4e-=4OH- |
| C、装置X能实现燃料电池的氢气和氧气再生 |
| D、装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
下列化学式只表示一种分子的是( )
| A、C2H6O |
| B、(C6H10O5)n |
| C、-CH2CH3 |
| D、C2H4 |
