题目内容
 (1)将一个用金属铝做的易拉罐充满CO2,然后往罐内注入足量的NaOH的溶液.用胶布封罐口,经过一段时间后,罐壁内凹而瘪,再过一段时间后,罐壁又重新鼓起.
(1)将一个用金属铝做的易拉罐充满CO2,然后往罐内注入足量的NaOH的溶液.用胶布封罐口,经过一段时间后,罐壁内凹而瘪,再过一段时间后,罐壁又重新鼓起.①罐壁内凹而瘪的原因是
②罐再鼓起的原因是
(2)某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4、
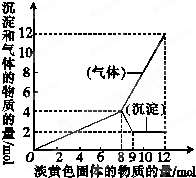
、Al3+,当加入一种淡黄色固体并加热溶液时,有刺激性气味气体放出和白色沉淀生成.加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系如图所示,据图可推知溶液中含有的离子是
考点:铝的化学性质,离子方程式的有关计算
专题:计算题,元素及其化合物
分析:(1)①CO2能和氢氧化钠发生反应,利用瓶内压强变化来解释;
②金属铝能和强碱反应生成氢气,利用瓶内压强变化来解释;
(2)淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象实际为两个图合在一起,较上的是气体,较下的是沉淀,图象中加入8mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe2+和Cu2+,一定有NH4+、Al3+、Mg2+,由图可知氢氧化镁为2mol,氢氧化铝为4mol-2mol=2mol,根据元素守恒计算Al3+、Mg2+物质的量,加入8mol过氧化钠之后,生成气体减小,故加入8mol过氧化钠时,铵根离子完全反应,计算加入8mol过氧化钠生成氧气的物质的量,再计算氨气物质的量,进而计算n(NH4+).
②金属铝能和强碱反应生成氢气,利用瓶内压强变化来解释;
(2)淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象实际为两个图合在一起,较上的是气体,较下的是沉淀,图象中加入8mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe2+和Cu2+,一定有NH4+、Al3+、Mg2+,由图可知氢氧化镁为2mol,氢氧化铝为4mol-2mol=2mol,根据元素守恒计算Al3+、Mg2+物质的量,加入8mol过氧化钠之后,生成气体减小,故加入8mol过氧化钠时,铵根离子完全反应,计算加入8mol过氧化钠生成氧气的物质的量,再计算氨气物质的量,进而计算n(NH4+).
解答:
解:(1)①CO2能和氢氧化钠发生反应CO2+2NaOH=Na2CO3+H20,CO2被吸收,使罐内气体压强减小而被外界大气压压瘪,
故答案为:CO2被吸收,使罐内气体压强减小而被外界大气压压瘪;CO2+2NaOH=Na2CO3+H20;
②因易拉罐是铝制的,过量的NaOH可以与罐壁(Al)反应:2Al+2NaOH+2H2O=2NaAlO2 +3H2↑,产生氢气,导致压强增大,罐壁重新鼓起,
故答案为:过量的NaOH和罐壁(Al)反应而产生H2使罐内压强增大而将罐壁重新鼓起;2Al+2NaOH+2H2O=2NaAlO2 +3H2↑;
(2)淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象实际为两个图合在一起,较上的是气体,较下的是沉淀,图象中加入8mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe2+和Cu2+,一定有NH4+、Al3+、Mg2+,加入8mol过氧化钠之后,生成气体减小,故加入8mol过氧化钠时,铵根离子完全反应,
由纵坐标可知:n(Mg2+)=n[Mg(OH)2]=2mol,n(Al3+)=4mol-n[Mg(OH)2]=2mol.
当n(Na2O2)=8mol时,由2Na2O2+2H2O=4NaOH+O2↑,可知n(O2)=8mol×
=4mol,所以n(NH4+)=n(NH3)=10mol-n(O2)=6mol,
故n(Mg2+):n(Al3+):n(NH4+)=2mol:2mol:6mol=1:1:3,
(2)由上述分析可知,淡黄色固体为:Na2O2,
故答案为:NH4+、Al3+、Mg2+;c(Mg2+):c(Al3+):c(NH4+)=1:1:3;Na2O2.
故答案为:CO2被吸收,使罐内气体压强减小而被外界大气压压瘪;CO2+2NaOH=Na2CO3+H20;
②因易拉罐是铝制的,过量的NaOH可以与罐壁(Al)反应:2Al+2NaOH+2H2O=2NaAlO2 +3H2↑,产生氢气,导致压强增大,罐壁重新鼓起,
故答案为:过量的NaOH和罐壁(Al)反应而产生H2使罐内压强增大而将罐壁重新鼓起;2Al+2NaOH+2H2O=2NaAlO2 +3H2↑;
(2)淡黄色固体加入溶液中,并加热溶液时,有刺激性气体放出和白色沉淀生成,则淡黄色固体为Na2O2,图象实际为两个图合在一起,较上的是气体,较下的是沉淀,图象中加入8mol过氧化钠后,沉淀减小,且没有完全溶解,则溶液中一定没有Fe2+和Cu2+,一定有NH4+、Al3+、Mg2+,加入8mol过氧化钠之后,生成气体减小,故加入8mol过氧化钠时,铵根离子完全反应,
由纵坐标可知:n(Mg2+)=n[Mg(OH)2]=2mol,n(Al3+)=4mol-n[Mg(OH)2]=2mol.
当n(Na2O2)=8mol时,由2Na2O2+2H2O=4NaOH+O2↑,可知n(O2)=8mol×
| 1 |
| 2 |
故n(Mg2+):n(Al3+):n(NH4+)=2mol:2mol:6mol=1:1:3,
(2)由上述分析可知,淡黄色固体为:Na2O2,
故答案为:NH4+、Al3+、Mg2+;c(Mg2+):c(Al3+):c(NH4+)=1:1:3;Na2O2.
点评:本题考查金属铝的性质、无机离子推断、化学图象计算等,综合性很强,根据图象结合离子反应判断含有的离子是关键,难度很大,注意开始阶段加热,会生成氨气逸出.

练习册系列答案
相关题目
海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
| A、从海水中可以得到NaCl,电解熔融NaCl 可制备Cl2和Na |
| B、海水蒸发制海盐的过程中只发生了化学变化 |
| C、海水中含有钾元素,只需经过物理变化就可以得到钾单质 |
| D、利用潮汐发电是将化学能转化为电能 |
用一定方法可除去下列物质所含的少量杂质(括号内为杂质).其中加适量的稀盐酸能达到除去杂质的目的是( )
| A、NaHCO3 (Na2CO3) |
| B、NaCl(NaOH) |
| C、Fe2O3(MgO) |
| D、FeCl3(FeCl2) |
一定温度下,向一固定容积的容器中放入1mol A和1mol B,待反应A(s)+B(g)?C(g)+2D(g)达到平衡时,C的体积分数是M%,在相同的条件下,若按以下配比开始反应,平衡时C的体积分数比为M%的是( )
| A、2molA+2molB |
| B、1molD+2molC |
| C、2molD+1molA+1molB |
| D、1molA+0.5molB+0.5molC+1.0molD |
下列说法正确的是( )
| A、常温下,某溶液中由水电离的c(OH-)=10-3 mol/L,则该溶液可能为NH4Cl或NaOH溶液 |
| B、常温时浓度均为1 mol/L的KHCO3和K2CO3溶液中,由水电离的c(OH-)前者大于后者 |
| C、1 mL pH=1的H2SO4与100 mLNaOH溶液混合后pH=7,则原NaOH溶液pH=11 |
| D、25℃时pH=5的CH3COOH溶液和100℃时pH=5的AlCl3溶液c(H+)相等 |
 按如图装置进行实验,并回答下列问题:
按如图装置进行实验,并回答下列问题: