题目内容
下列变化中,需加入适当的氧化剂才能完成的是( )
| A、Fe→FeCl3 |
| B、CuO→Cu |
| C、Cl2→HClO |
| D、SiO2→Na2SiO3 |
考点:重要的氧化剂
专题:氧化还原反应专题
分析:需加入适当的氧化剂才能完成,则选项中应为还原剂的氧化反应,还原剂中某元素的化合价升高,以此来解答.
解答:
解:A.Fe→FeCl2中,Fe元素的化合价升高,需加氧化剂,故A选;
B.CuO→Cu中,Cu元素的化合价降低,需加还原剂,故B不选;
C.Cl2→HClO中,Cl元素的化合价升高,氯气与水反应生成HClO,反应中氯气即是氧化剂又是还原剂,所以不需加氧化剂剂,故C不选;
D.SiO2→Na2SiO3中,元素的化合价不变,不需发生氧化还原反应,故D不选;
故选A.
B.CuO→Cu中,Cu元素的化合价降低,需加还原剂,故B不选;
C.Cl2→HClO中,Cl元素的化合价升高,氯气与水反应生成HClO,反应中氯气即是氧化剂又是还原剂,所以不需加氧化剂剂,故C不选;
D.SiO2→Na2SiO3中,元素的化合价不变,不需发生氧化还原反应,故D不选;
故选A.
点评:本题考查氧化还原反应,明确反应中元素的化合价及基本概念即可解答,注意还原剂中某元素的化合价升高,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列溶液中,一定能大量共存的微粒组是( )
| A、室温下,pH=1的溶液中:Na+、Fe2+、NO-3、SO42- |
| B、由水电离的c(H+)=1×10-13 mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
| C、含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42- |
| D、c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- |
设NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、78g Na2O2与足量水充分反应时电子转移数为2NA |
| B、1 mol Na完全转化为Na2O2时,失去的电子数目为2NA |
| C、4℃、101.3kPa时,54mL H2O中含有的分子数为3NA |
| D、2L1mol/L Na2SO4溶液中离子总数为3NA |
下列关于NaCl的分类不正确的是( )
| A、化合物 | B、氧化物 |
| C、氯化物 | D、钠盐 |
将一定量的NaHCO3和NH4HCO3的混合物放入坩埚内,用酒精加热到质量不变时,最终称得残留物得质量是原来的一半,则原混合物中NH4HCO3的质量数为 ( )
| A、25% |
| B、20.75% |
| C、17.85% |
| D、26.45% |
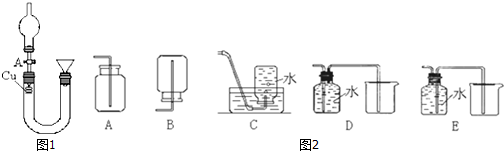
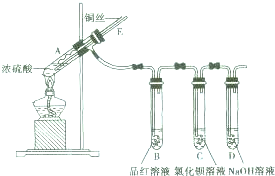 某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示.实验步骤:
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示.实验步骤: