题目内容
10.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 标准状况下22.4LCCl4含有C-Cl键的数目为4NA | |
| B. | 电解精炼铜时,若转移的电子数为NA个,则阳极减小质量为32g | |
| C. | 电解旅58.5g熔融NaCl,标准状况能产生22.4L氯气、23.0g金属钠 | |
| D. | 己知N2(g)+3H2(g)=2NH3(g)△H=-40.3kJ•mol-1,则在相同条件下通入6molH2和2molN2进行该反应时放出热量小于80.6kJ |
分析 A、标况下四氯化碳为液体;
B、电解精炼铜时,阳极上放电的不只是铜;
C、求出氯化钠的物质的量,然后根据1mol氯化钠电解生成1mol钠和0.5mol氯气来分析;
D、合成氨的反应为可逆反应.
解答 解:A、标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量和含有的C-Cl键的个数,故A错误;
B、电解精炼铜时,阳极上放电的不只是铜,还有比铜更活泼的金属,故阳极减少的质量小于32g,故B正确;
C、58.5g氯化钠的物质的量为1mol,而1mol氯化钠电解生成1mol钠和0.5mol氯气,故在标况下生成11.2L氯气和23g钠,故C错误;
D、合成氨的反应为可逆反应,故6mol氢气和2mol氮气不能反应完全,故放出的热量小于80.6KJ,故D正确.
故选BD.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
20.下列有机反应中,与其它三个反应类型不同的是( )
| A. |  | |
| B. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | |
| C. | 2C2H5OH→C2H5-O-C2H5+H2O | |
| D. |  |
1.碳化硅(SiC)陶瓷基复合材料是一种新型热结构材料.在空气中,碳化硅能与熔融的氢氧化钠发生反应:SiC+2NaOH+2O2═Na2SiO3+X+H2O,下列有关X物质的化学式推断中,正确的是( )
| A. | SiO2 | B. | CO | C. | CO2 | D. | Na2CO3 |
18.下列离子化合物中,阴、阳离子个数比与其他化合物不同的是( )
| A. | Na2O2 | B. | Na2O | C. | Na2S | D. | NH4HSO4 |
5.用NA表示阿伏加德罗常数,下列叙述中不正确的是( )
| A. | 14 g乙烯和丙烯的混合物中总原子数为3NA个 | |
| B. | 106gNa2CO3固体中含有NA个CO32- | |
| C. | 200mL0.5 mol•L-1的Na2CO3溶液中阴离子数目小于0.1 NA | |
| D. | 常温下,1 mol Cu和足量浓硝酸反应可收集NO2的分子数小于2NA |
15.下列有关离子浓度的关系正确的是( )
| A. | Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| B. | 25℃时pH=10的NaOH溶液与pH=10的氨水中:c(Na+)=c(NH4+) | |
| C. | 25℃时pH=9、浓度均为0.1mol/L的NH3•H2O、NH4Cl混合溶液:c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| D. | 0.1mol/L(NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
19.研究表明,缺碘会引起甲状腺肿大,可从海带中补碘.这里的“碘”是指( )
| A. | 碘原子 | B. | 碘分子 | C. | 碘离子 | D. | 碘元素 |
20.下列实验操作对应的图象不正确的是( )
| 选项 | A | B | C | D |
| 实验操作 | 向MgCl2、AlCl3溶液中(各1mol),逐滴加入NaOH溶液 | 向HCl、MgCl2、AlCl3、NH4Cl溶液中(各1mol),逐滴加入NaOH溶液 | 向NaOH、NaAlO2溶液中(各1mol),逐滴加入HCl溶液 | 向NaOH、Na2CO3混合溶液中(各1mol)滴加稀盐酸 |
| 图象 | 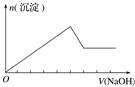 |  | 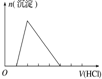 | 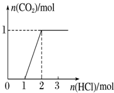 |
| A. | A | B. | B | C. | C | D. | D |