题目内容
12.平衡指的是两个相反方向的变化最后所处的运动状态;在平衡时,两种变化仍在继续进行,但是它们的速率相等;根据变化的性质可分为物理平衡和化学平衡,中学阶段涉及的平衡有气体可逆反应的平衡、酸碱电离平衡、水解平衡及沉淀-溶解平衡等等.(1)现有容积为1L的恒温恒容密闭容器,向其中加入2mol A气体和2mol B气体后发生如下反应:
A(g)+B(g)?C(g)△H=-a kJ•mol-1
20s后,反应达到平衡状态,生成1mol C气体,放出热量Q1kJ.回答下列问题.
①计算20s内B气体的平均化学反应速率为0.05mol/(L•s),写出该反应的平衡常数表达式K=$\frac{c(C)}{c(A)•c(B)}$.
②保持容器温度和容积不变,若改为向其中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1与Q2的相互关系正确的是C(填字母).
(A)Q1+Q2=a (B) Q1+2Q2<2a (C)Q1+2Q2>2a (D)Q1+Q2<a
③在原平衡基础上,保持容器温度和容积不变,向容器中再通入b mol A气体(b>0)时,v(正)>v(逆)(填“>”、“<”或“=”),重新达平衡后,C气体的平衡体积分数ϕ(C)=$\frac{1}{3}$,则b=$\frac{4}{3}$.
(2)常温下,将VmL、0.1000mol•L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol•L-1醋酸溶液中,充分反应.回答下列问题.(忽略溶液体积的变化)
①如果溶液pH=7,此时V的取值<20.00(填“>”、“<”或“=”),而溶液中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小关系为c(Na+)=c(CH3COO-)>c(H+)=c(OH-).
②如果V=40.00,则此时溶液中c(OH-)-c(H+)-c(CH3COOH)=$\frac{1}{30}$mol•L-1.
分析 (1)①根据反应速率v=$\frac{△c}{△t}$计算;平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积;
②加入1molA气体和1molB气体与加入1molC气体是在保持恒温、恒容情况下是等效平衡,加入2molA气体和2molB气体与加入1molA气体和1molB气体相比,相当于增大一倍的压强,增大压强,反应向体积缩小的方向正向移动;
③增加反应物的浓度平衡向正反应方向移动,由题意2 mol A气体和2 mol B气体生成1 mol C气体,根据三段式求得平衡常数K=1,依据温度不变,平衡常数不变进行解答;
(2)①溶液的酸碱性是根据溶液中H+浓度与OH-浓度的相对大小判断的,只要溶液中c(H+)=c(OH-),溶液就呈中性,CH3COOH是弱电解质,电离程度不大,NaOH是强电解质,完全电离,反应生成的乙酸钠是强碱弱酸盐水解呈碱性,需溶液呈中性,需少加碱;结合电荷守恒分析;
②根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒c(Na+)=2[c(CH3COO-)+c(CH3COOH)]进行解答.
解答 解:(1)①容积为1L的恒温恒容密闭容器,20s内生成1molC气体,根据A(g)+B(g)?C(g)△H=-a kJ•mol-1,B气体减少1mol,浓度变化减少1.0 mol/L,c(B)=1.0mol/L,△t=20s,v=$\frac{△c}{△t}$=$\frac{1.0mol/L}{20s}$=0.05mol/(L•s),已知A(g)+B(g)?C(g),则该反应的化学平衡常数K=$\frac{c(C)}{c(A)•c(B)}$,
故答案为:0.05mol/(L•s);K=$\frac{c(C)}{c(A)•c(B)}$
②设加入1molA气体和1molB气体达到平衡时,放出的热量为Q3,根据等效平衡可知:保持容器温度和容积不变,加入1molA气体和1molB气体与加入1molC气体是等效的,则Q2+Q3=a=Q1,又知保持容器温度和容积不变,加入2molA气体和2molB气体与加入1molA气体和1molB气体相比,相当于增大一倍的压强,A(g)+B(g)?C(g)从起始量分析,正反应是体积缩小的反应,增大压强,反应向体积缩小的方向移动,所以平衡正向移动,所以放出的热量Q1>2Q3,所以Q1 +2Q2>2a,所以选:C;
故答案为:C;
③增加反应物的浓度,正反应速率增大,所以v(正)>v(逆);
由题意2molA气体和2molB气体生成1molC气体,根据三段式:
A(g)+B(g)=C(g)
开始(mol/L) 2 2 0
反应(mol/L) 1 1 1
平衡(mol/L) 1 1 1
平衡常数K=$\frac{1mol/L}{1mol/L×1mol/L}$=1,再通入bmolA气体,温度不变,平衡常数不变,根据三段式:
A(g)+B(g)=C(g)
开始(mol/L) 2+b 2 0
反应(mol/L) x x x
平衡(mol/L)2+b-x 2-x x
又知K=1,$\frac{x}{(2+b-x)(2-x)}$=1,C气体的平衡体积分数为$\frac{1}{3}$,所以$\frac{x}{4+b-x}$=$\frac{1}{3}$,解得b=$\frac{4}{3}$,x=$\frac{4}{3}$;
故答案为:>;$\frac{4}{3}$;
(2)①CH3COOH是弱电解质,电离程度不大,NaOH是强电解质,完全电离,反应生成的乙酸钠是强碱弱酸盐,水解呈碱性,需溶液呈中性pH=7,需少加碱,所以常温下,将V mL、0.1000mol•L-1氢氧化钠溶液逐滴加入到20.00mL、0.1000mol•L-1醋酸溶液中,充分反应,V<20.00mL溶液呈中性pH=7,c(H+)=c(OH-);根据溶液中的电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)可知:c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
故答案为:<;c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
②根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒c(Na+)=2[c(CH3COO-)+c(CH3COOH)],得到c(H+)+c(CH3COO-)+2c(CH3COOH)=c(OH-),则c(OH-)-c(H+)-c(CH3COOH)=c(CH3COO-)+c(CH3COOH),反应后溶液的体积变为60mL,则c(CH3COO-)+c(CH3COOH)═$\frac{0.1000mol•L-1×20mL}{60mL}$=$\frac{1}{30}$mol/L,
故答案为:$\frac{1}{30}$.
点评 本题主要考查了反应速率的计算、化学平衡的有关计算、弱电解质和盐的水解等,掌握化学平衡常数的计算方法,以及化学平衡移动原理知识的灵活运用是解答的关键,是一道综合知识题目,题目难度较大.

| A. | Al(OH)3溶于稀H2SO4中:OH-+H+═H2O | |
| B. | 氨水滴入Al(Cl)3溶液中:Al3++3OH-═Al(OH)3 | |
| C. | MgO溶于稀HCl中:O2-+2H+═H2O | |
| D. | 铝溶解在NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
| A. | 粗铜板作阳极 | |
| B. | 电解时,阴极反应为Cu2++2e-=Cu | |
| C. | 电解铜的纯度可达99.95%~99.95% | |
| D. | 粗铜中所含的锌、镍、银等,电解后均以单质形式沉积槽底 |
| A. | N、O、F最高正价依次升高 | |
| B. | Al3+、Na+、O2-微粒半径依次增大 | |
| C. | F2、Cl2、Br2、I2单质的熔点逐渐降低 | |
| D. | 锂、钠、钾、铷单质与水反应置换出氢气越来越难 |
| A. | KSCN | B. | BaCl2 | C. | NaOH | D. | HCl |
| A. | 红色、紫色、红色 | B. | 黄色、红色、无色 | C. | 黄色、紫色、无色 | D. | 黄色、紫色、红色 |
| A. | 尽量购买本地的、当季的食物 | |
| B. | 用双氧水代替高锰酸钾制氧气 | |
| C. | 用溴水代替碘水进行萃取实验 | |
| D. | 用铜粉代替铜丝进行Cu与浓HNO3的反应 |
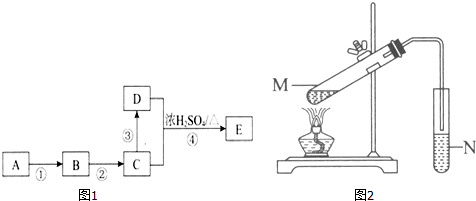
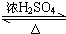 CH3COOC2H5+H2O;下列说明该反应已经达到化学平衡状态的是ad.
CH3COOC2H5+H2O;下列说明该反应已经达到化学平衡状态的是ad. 某课外活动小组利用如图所示装置制取氯气.提供的试剂有:浓盐酸、饱和食盐水,氢氧化钠溶液、高锰酸钾固体.反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
某课外活动小组利用如图所示装置制取氯气.提供的试剂有:浓盐酸、饱和食盐水,氢氧化钠溶液、高锰酸钾固体.反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O