题目内容
2.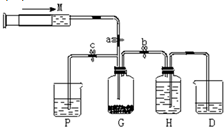 某课外活动小组利用如图所示装置制取氯气.提供的试剂有:浓盐酸、饱和食盐水,氢氧化钠溶液、高锰酸钾固体.反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
某课外活动小组利用如图所示装置制取氯气.提供的试剂有:浓盐酸、饱和食盐水,氢氧化钠溶液、高锰酸钾固体.反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O(1)装置H中盛放的试剂是饱和食盐水.
(2)尾气处理时关闭弹簧夹a和弹簧夹b,打开弹簧夹c.
(3)处理尾气时,发生反应的化学方程式是2NaOH+Cl2=NaCl+NaClO+H2O.
(4)用含0.032mol HCl的浓盐酸跟足量高锰酸钾固体反应,产生氯气的物质的量应小于 (填“大于”,“等于”或“小于”)0.01mol.
分析 (1)氯气易溶于水,在饱和氯化钠溶液中溶解度较小;
(2)由题意可知用仪器A吸收过量的氯气;
(3)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(4)根据反应原理只有浓盐酸才反应,随着反应的进行盐酸要变稀,所以氯化氢不可能全部反应;
解答 解:(1)氯气易溶于水,在饱和氯化钠溶液中溶解度较小,所以可以用排饱和食盐水的方法收集氯气,装置C中为饱和食盐水,
故答案为:饱和NaCl溶液;
(2)由题意可知用仪器A吸收过量的氯气,要想使反应剩余气体进入A,应关闭弹簧夹a和弹簧夹b,打开弹簧夹c;
故答案为:b;c;
(3)氯气有毒,所以不能直接排空,氯气和水能反应生成酸,酸和碱反应,所以可用碱液吸收氯气,氯气和碱反应生成盐、次氯酸盐、水,方程式:Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(4)依据2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,若0.032mol HCl全部反应,则生成氯气物质的量为0.01mol,但是根据反应原理只有浓盐酸才反应,随着反应的进行盐酸要变稀,稀盐酸不能与高锰酸钾反应,所以实际产生氯气物质的量小于0.01mol;
故答案为:小于.
点评 本题考查了氯气的制法和有关氧化还原的计算,题目难度中等,熟悉物质的性质和制备原理,明确氧化还原反应的规律是解题关键,注意盐酸浓度对反应的影响.

练习册系列答案
相关题目
10.常温时向0.01mol/L 的盐酸溶液中加入等体积的下列溶液,滴入酚酞试液显红色,该溶液是( )
| A. | pH=12的Ba(OH)2溶液 | B. | pH=12的氨水 | ||
| C. | 0.01mol/L AgNO3溶液 | D. | 0.005mol/L NaOH溶液 |
17.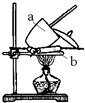 碳酸钠在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体(Na2CO3•nH2O)样品,可采用在不同温度下加热样品(温度逐渐升高)来测定其组成.
碳酸钠在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体(Na2CO3•nH2O)样品,可采用在不同温度下加热样品(温度逐渐升高)来测定其组成.
(1)某学生的实验流程如下:

①称量用的仪器是托盘天平,最小量度单位0.1g.
②如图为灼烧装置.下列对应仪器的名称中,若正确的在后面横线上写上“正确”,若错误请将正确名称写在后面横线上.
a.坩锅正确 b.三脚架泥三角
③流程中“操作”是指冷却,这一操作必须放在干燥器(填仪器名称)中进行.
④该学生停止实验的依据为连续两次称量的质量差不超过0.1g.
⑤实验结果记录如下:容器质量为33.6g
根据上表数据推算出n值,n=10.
(2)另有学生测定结果n值偏小,其可能的原因为b、c.
a.温度过高致少量碳酸钠分解了 b.碳酸钠晶体样品已有少量风化
c.碳酸钠晶体样品没有完全失去结晶水 d.加热过程中有少量晶体溅出.
 碳酸钠在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体(Na2CO3•nH2O)样品,可采用在不同温度下加热样品(温度逐渐升高)来测定其组成.
碳酸钠在不同温度下可以失去部分或全部的结晶水,现有一种碳酸钠晶体(Na2CO3•nH2O)样品,可采用在不同温度下加热样品(温度逐渐升高)来测定其组成.(1)某学生的实验流程如下:

①称量用的仪器是托盘天平,最小量度单位0.1g.
②如图为灼烧装置.下列对应仪器的名称中,若正确的在后面横线上写上“正确”,若错误请将正确名称写在后面横线上.
a.坩锅正确 b.三脚架泥三角
③流程中“操作”是指冷却,这一操作必须放在干燥器(填仪器名称)中进行.
④该学生停止实验的依据为连续两次称量的质量差不超过0.1g.
⑤实验结果记录如下:容器质量为33.6g
| 称量次序 | 加热温度(℃) | 容器+试样质量(g) |
| Ⅰ | 常温 | 62.2 |
| Ⅱ | T1 | 56.8 |
| Ⅲ | T2 | 49.6 |
| Ⅳ | T3 | 44.2 |
| Ⅴ | T4 | 44.2 |
(2)另有学生测定结果n值偏小,其可能的原因为b、c.
a.温度过高致少量碳酸钠分解了 b.碳酸钠晶体样品已有少量风化
c.碳酸钠晶体样品没有完全失去结晶水 d.加热过程中有少量晶体溅出.
7.下列化学用语书写正确的是( )
| A. | 明矾的化学式为:KAl(SO4)2 | |
| B. | 氯离子的结构示意图为: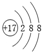 | |
| C. | 纯碱的化学式:NaCO3 | |
| D. | 氨水的电离方程式:NH3•H2O→NH4++H2O |
14.在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知vB=3vA,3vC=2vB,则此反应可表示为( )
| A. | 2 A+3 B→2 C | B. | A+3 B→2 C | C. | 3 A+B→2 C | D. | A+B→C |
11.2012年7月21日,北京地区突降近60年最大的暴雨,造成水灾.为确保大灾之后无大疫,当地防疫部门使用了含氯类消毒剂,其中ClO2是一种消毒杀菌效率较高的消毒剂,有强氧化性.工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化制得.则有关此反应的说法正确的是( )
| A. | NaClO3是还原剂 | |
| B. | 氧化性:ClO2>NaClO3 | |
| C. | 化学反应方程式为:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O | |
| D. | 1 mol NaClO3参加反应有2 mol e-转移 |
