题目内容
3.芳樟醇( )是一种名贵的香料,又是合成VE、VA、紫罗兰酮、胡萝卜素等的中间体.合成芳樟醇的一种方法如下:
)是一种名贵的香料,又是合成VE、VA、紫罗兰酮、胡萝卜素等的中间体.合成芳樟醇的一种方法如下: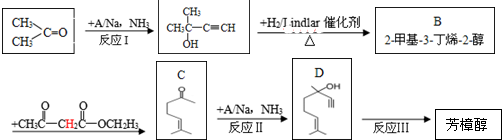
(1)B的结构简式为
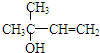 ,C分子中的官能团名称为羰基、碳碳双键,已知反应I和反应Ⅱ的原子利用率100%,则A的结构简式为HC≡CH.
,C分子中的官能团名称为羰基、碳碳双键,已知反应I和反应Ⅱ的原子利用率100%,则A的结构简式为HC≡CH.(2)反应Ⅲ的试剂和条件为H2,Lindlar催化剂并加热.
(3)反应I还可得到分子式为的C8H14O2副产物,其核磁共振氢谱有两个吸收峰,则生成此副产物的化学方程式为
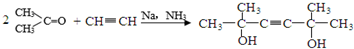 .
.(4)D在催化剂作用下异构化为柠檬醛
 ,写出柠檬醛的另一种同分异构体的结构简式(不改变分子中原子的连接方式)
,写出柠檬醛的另一种同分异构体的结构简式(不改变分子中原子的连接方式)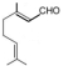 ;芳樟醇在H+作用下也可异构化为香叶醇(
;芳樟醇在H+作用下也可异构化为香叶醇(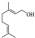 ).下列有关柠檬醛的下列说法正确的是BCD
).下列有关柠檬醛的下列说法正确的是BCDA.与银氨溶液反应并酸化可得到柠檬酸(分子式为C6H8O7)
B.香叶醇和柠檬醛在一定条件下可以互相转化
C.能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色
D.一定条件下能与乙炔发生加成反应
E.分子中所有碳原子共平面.
分析 (1)根据B的名称书写结构简式,含有羟基、碳碳双键的碳链为主链,从距离羟基最近的一段进行编号;由C的结构简式可知含有的官能团有羰基、碳碳双键;反应I的原子利用率100%,属于加成反应,对比物质的结构简式可知A为HC≡CH;
(2)对比D与芳樟醇的结构可知,D中碳碳三键与氢气按1:1发生加成反应生成芳樟醇,与生成B的条件相同;
(3)反应I还可得到分子式为的C8H14O2副产物,其核磁共振氢谱有两个吸收峰,应是1分子乙炔与2分子丙酮发生加成反应生成 ;
;
(4)存在顺反异构,另一种同分异构体为顺式结构;
A.与银氨溶液反应并酸化,-CHO转化为-COOH;
B.香叶醇中羟基发生催化氧化得到柠檬醛;
C.含有碳碳双键、醛基,能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色;
D.醛基能与乙炔发生反应I中的加成反应;
E.碳碳双键通过2个亚甲基相连,旋转碳碳单键可能共平面,但结构中不一定共平面.
解答 解:(1)根据B的名称,可知结构简式为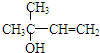 ,由C的结构简式可知含有的官能团有羰基、碳碳双键;反应I的原子利用率100%,属于加成反应,对比物质的结构简式可知A为HC≡CH,
,由C的结构简式可知含有的官能团有羰基、碳碳双键;反应I的原子利用率100%,属于加成反应,对比物质的结构简式可知A为HC≡CH,
故答案为: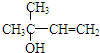 ;羰基、碳碳双键;HC≡CH;
;羰基、碳碳双键;HC≡CH;
(2)对比D与芳樟醇的结构可知,D中碳碳三键与氢气按1:1发生加成反应生成芳樟醇,与生成B的条件相同,反应Ⅲ的试剂和条件为:H2,Lindlar催化剂并加热,
故答案为:H2,Lindlar催化剂并加热;
(3)反应I还可得到分子式为的C8H14O2副产物,其核磁共振氢谱有两个吸收峰,应是1分子乙炔与2分子丙酮发生加成反应生成 ,生成此副产物的化学方程式为:
,生成此副产物的化学方程式为: ,
,
故答案为: ;
;
(4)存在顺反异构,另一种同分异构体为顺式结构,结构简式为: ,
,
A.与银氨溶液反应并酸化,-CHO转化为-COOH,柠檬酸分子式为C10H16O2,故A错误;
B.香叶醇中羟基发生催化氧化得到柠檬醛,故B正确;
C.含有碳碳双键、醛基,能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色,故C正确;
D.醛基能与乙炔发生反应I中的加成反应,故D正确;
E.碳碳双键通过2个亚甲基相连,旋转碳碳单键可能共平面,但结构中不一定共平面,故E错误.
故答案为: ;BCD.
;BCD.
点评 本题考查有机物的合成、有机物结构与性质、有机物命名、同分异构体等,是对有机化学基础的综合考查,难度中等.

| A. | 小苏打常用于配制波尔多液 | B. | 氮气、氨和干冰常用作制冷剂 | ||
| C. | Fe3O4常用作红色油漆和涂料 | D. | Na2O常用作呼吸面具中氧气的来源 |
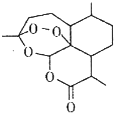 屠呦呦团队发现并提取了青蒿素(结构如图),开创疟疾治疗新方法;屠呦呦因此荣获2015年诺贝尔生理学或医学奖.下列有关青蒿素的叙述错误的是( )
屠呦呦团队发现并提取了青蒿素(结构如图),开创疟疾治疗新方法;屠呦呦因此荣获2015年诺贝尔生理学或医学奖.下列有关青蒿素的叙述错误的是( )| A. | 分子式为C15H22O5 | B. | 属于芳香族化合物 | ||
| C. | 能与Cl2发生取代反应 | D. | 能与NaOH溶液反应 |
Ⅰ.脱硝:已知:H2的热值为142.9KJ•g-1
N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
H2O(g)=H2O(l)△H=-44kJ•mol-1
催化剂存在下,H2还原NO2生成水蒸气和其它无毒物质的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1.
Ⅱ.脱碳:向2L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)═CH3OH(l)+H2O(l)
(1)①该反应自发进行的条件是低温(填“低温”、“高温”或“任意温度”)
②下列叙述能说明此反应达到平衡状态的是d e.
a、混合气体的平均式量保持不变 b、CO2和H2的体积分数保持不变
c、CO2和H2的转化率相等 d、混合气体的密度保持不变
e、1mol CO2生成的同时有3mol H-H键断裂
③CO2的浓度随时间(0~t2)变化如图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6CO2的浓度随时间的变化.
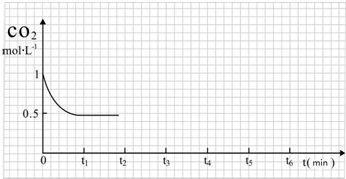
(2)改变温度,使反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0 中的所有物质都为气态.起始温度体积相同(T1℃、2L密闭容器).反应过程中部分数据见下表:
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
②对反应I,前10min内的平均反应速率v(CH3OH)=0.025mol•L-1•min-1,在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1<T2(填“>”、“<”或“=”).
若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),则平衡不移动(填“正向”、“逆向”或“不”).
| A. | 将CO2转化为燃料可减少CO2温室气体的排放 | |
| B. | CO2转化为HCOOH过程是CO2被还原的过程 | |
| C. | 新型电催化材料降低了CO2催化还原的活化能 | |
| D. | 新型电催化材料提高了CO2还原为HCOOH的平衡常数 |
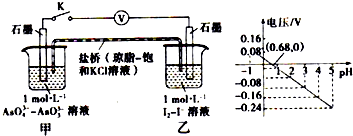 某实验小组依据反应 AsO43-+2H++2I-?AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得电压与pH的关系如图.下列有关叙述错误的是( )
某实验小组依据反应 AsO43-+2H++2I-?AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得电压与pH的关系如图.下列有关叙述错误的是( )| A. | pH=0.68时,反应处于平衡状态 | |
| B. | 调节pH可以改变反应的方向 | |
| C. | pH>0.68时,负极电极反应式为2I--2e -═I2 | |
| D. | pH=5时,氧化性I2>AsO43- |
| A. | 等物质的量的O2和CO2所含氧原子数均为2NA | |
| B. | 标准状况下,2.24 L一氯甲烷中含有氢原子数目为0.3NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA | |
| D. | 6.8 g熔融的KHSO4中含有0.1 NA个阳离子 |
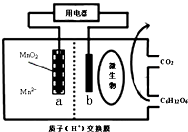
| A. | H+向左移动 | |
| B. | 电子由a极沿导线流向b极 | |
| C. | b极电极反应式为:C6H12O6-24e-+6H2O=6CO2+24H+ | |
| D. | 当电路中转移0.2mole-时,a极质量减少8.7g |
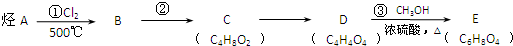
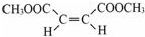 ;在其HNMR谱中,有2种峰,其峰面积比为1:3.E能发生聚合反应,写出其化学方程式
;在其HNMR谱中,有2种峰,其峰面积比为1:3.E能发生聚合反应,写出其化学方程式
 .
.