题目内容
11.某温度时,水的离子积常数KW=10-13,将此温度下pH=11的Ba(OH)2溶液a L与pH=1的H2SO4溶液b L混合(设混合溶液体积为两者之和,固体体积忽略不计).下列说法不正确的是( )| A. | 若所得混合溶液为中性,则a:b=1:1 | |
| B. | 若所得混合溶液为中性,则生成沉淀的物质的量为0.05b mol | |
| C. | 若a:b=9:2,则所得溶液pH等于2 | |
| D. | 若a:b=9:2,则该混合溶液最多能溶解铁粉0.28(a+b)g |
分析 该温度下,pH=11的Ba(OH)2溶液中c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,pH=1的H2SO4溶液中c(H+)=10-1 mol/L=0.1mol/L,
A.如果所得溶液呈中性,则酸中n(H+)等于碱中n(OH-);
B.如果所得溶液呈中性,则酸碱的物质的量相等,根据SO42-守恒计算生成沉淀的物质的量;
C.若a:b=9:2,设a=9x,b=2x,则c(H+)=$\frac{0.1×2x-0.01×9x}{9x+2x}$=0.01 mol•L-1,pH=-lgc(H+);
D.根据C知,n(H+)=0.01 mol•L-1×(a+b) L=0.01(a+b) mol,2H++Fe=Fe2++H2↑,根据Fe和氢离子之间的关系式计算.
解答 解:该温度下,pH=11的Ba(OH)2溶液中c(OH-)=$\frac{1{0}^{-13}}{1{0}^{-11}}$mol/L=0.01mol/L,pH=1的H2SO4溶液中c(H+)=10-1 mol/L=0.1mol/L,
A.如果所得溶液呈中性,则酸中n(H+)等于碱中n(OH-),所以0.01a=0.1b,则a:b=10:1,故A错误;
B.如果所得溶液呈中性,则酸碱的物质的量相等,n(H2SO4)=0.1mol/L×$\frac{1}{2}$×bL=0.05bmol,因为SO42-+Ba2+═BaSO4↓,所以用SO42-计算沉淀的物质的量:n=0.05b mol,故B正确;
C.若a:b=9:2,设a=9x,b=2x,则c(H+)=$\frac{0.1×2x-0.01×9x}{9x+2x}$=0.01 mol•L-1,pH=-lgc(H+)=-lg0.01=2,故C正确;
D.根据C知,n(H+)=0.01 mol•L-1×(a+b) L=0.01(a+b) mol,2H++Fe=Fe2++H2↑,根据Fe和氢离子之间的关系式计算得m(Fe)=n(Fe).M(Fe)=n(H+).M(Fe)=$\frac{1}{2}$×0.01(a+b) mol×56 g•mol-1=0.28(a+b)g,故D正确;
故选A.
点评 本题考查酸碱混合溶液定性判断及方程式的有关计算,为高频考点,明确各个物理量之间的关系是解本题关键,注意该温度下离子积常数不是10-14,注意酸中氢离子浓度与硫酸根离子浓度关系,题目难度中等.

 初中暑期衔接系列答案
初中暑期衔接系列答案| A. | 0.1molNa2O2与水反应转移电子数为0.1 NA | |
| B. | 标准状况下,11.2L HF含有的分子数为0.5 NA | |
| C. | 1mol S在足量O2中燃烧,转移的电子数为6 NA | |
| D. | 7.8g Na2O2固体中所含阴离子数为2 NA |
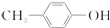 出发合成BHT的方法有如下两种.下列说法不正确的是( )
出发合成BHT的方法有如下两种.下列说法不正确的是( )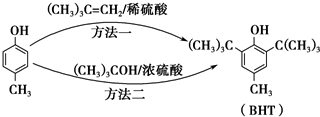
| A. | 推测BHT在水中的溶解度小于苯酚 | |
| B. | 方法一和方法二的反应类型都是加成反应 | |
| C. | BHT与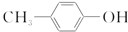 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 | |
| D. | BHT与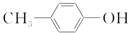 具有完全相同的官能团 具有完全相同的官能团 |
| A. | 不慎打翻燃着的酒精灯,立即用湿抹布盖灭 | |
| B. | 实验室制取氯气如果有尾气处理装置,可不用在通风橱中进行 | |
| C. | 给盛有液体的试管加热时,要不断移动试管或加入碎瓷片 | |
| D. | 浓碱液滴在皮肤上,立即用大量水冲洗,然后涂上硼酸溶液 |
| A. | 回收废旧电池 | |
| B. | 加强控制燃放烟花爆竹法规 | |
| C. | 停止使用含铅汽油 | |
| D. | 将工厂烟囱加高,减少周围大气污染 |
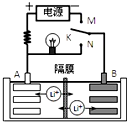 如图是一种可充电的锂离子电池充、放电的工作示意图.该电池的反应式为:
如图是一种可充电的锂离子电池充、放电的工作示意图.该电池的反应式为:LiMnO2+C6$?_{放电}^{充电}$Li1-xMnO2+LixC6(LixC6表示锂原子嵌入石墨形成的复合材料),下列有关说法正确的是( )
| A. | K与N相接时,A极为负极,该电极反应式为:LixC6-xeˉ=C6+xLi+ | |
| B. | 该电池的比能量与用单质锂作电极的锂电池的比能量相同 | |
| C. | K与M相接时,A极发生氧化反应,LiMnO2-xeˉ=Li1-xMnO2+xLi+ | |
| D. | K与N相接时,Li+由A极区迁移到B极区 |
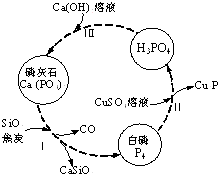 氮、磷及其化合物在科研及生产中均有着重要的应用.
氮、磷及其化合物在科研及生产中均有着重要的应用.