题目内容
20.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素叙述正确的是( )| A. | 气态氢化物的稳定性:D>C | B. | 原子半径:B>A>C>D | ||
| C. | 单质的还原性:B>A | D. | 原子序数:b>a>c>d |
分析 已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,结合元素周期律递变规律解答该题.
解答 解:已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则a-n=n-n-1=c+n=d+n+1,这说明A和B是金属,C和D是非金属,位于A和B的上一周期,原子数是b>a>c>d,
A.非金属性C>D,则氢化物的稳定性是C>D,故A错误;
B.同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则原子半径是A>B>D>C,故B错误;
C.同周期元素从左到右金属性逐渐减弱,还原性减弱,应为A>B,故C错误;
D.由以上分析可知原子序数是b>a>c>d,故D正确,
故选D.
点评 本题考查位置结构性质的相互关系及应用,为高考常见题型,根据核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
10.下列符号中表示两个阴离子的是( )
| A. | 2C1 | B. | 2S2- | C. | 2Fe2+ | D. | O2 |
15.下列说法正确的是( )
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| B. | 强电解质溶液不一定比弱电解质的导电性强 | |
| C. | HR型共价化合物一定是强电解质 | |
| D. | 强、弱电解质的导电性只由它们溶液的浓度决定 |
12.下列变化不能用勒夏特列原理解释的是( )
| A. | 工业生产硫酸的过程中使用过量的空气,以提高二氧化硫的转化率 | |
| B. | 氯化镁溶液加热蒸干最终得不到氯化镁固体 | |
| C. | 合成氨是放热反应,采用在较高温度下进行反应 | |
| D. | 实验室用排饱和食盐水的方法收集氯气 |
9.在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能.据此,试判断在100kPa压强下,下列结论正确的是( )
| A. | 金刚石比石墨稳定 | |
| B. | 1mol 石墨比1mol金刚石的总能量高 | |
| C. | 金刚石和石墨互为同位素 | |
| D. | 石墨比金刚石稳定 |
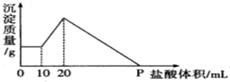 将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:
将由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水,充分反应后得到0.58g白色沉淀,向所得的浊液中逐滴加入0.5mol/L的盐酸,生成沉淀的质量与加入盐酸的体积的关系如图所示:
 在化学反应中,反应物转化成生成物,必然发生能量的变化.
在化学反应中,反应物转化成生成物,必然发生能量的变化.