题目内容
9.在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能.据此,试判断在100kPa压强下,下列结论正确的是( )| A. | 金刚石比石墨稳定 | |
| B. | 1mol 石墨比1mol金刚石的总能量高 | |
| C. | 金刚石和石墨互为同位素 | |
| D. | 石墨比金刚石稳定 |
分析 在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的能量说明石墨的能量低于金刚石的能量,金刚石的能量高,而石墨更稳定,据此分析.
解答 解:A、1mol石墨转化为金刚石,要吸收1.895kJ的能量,石墨转化为金刚石要吸收能量,说明石墨的能量低,石墨稳定,故A错误;
B、1mol石墨转化为金刚石,要吸收1.895kJ的能量,故说明石墨的能量低,故B错误;
C、金刚石和石墨均为碳元素的两种不同单质,故互为同素异形体,故C错误;
D、1mol石墨转化为金刚石,要吸收1.895kJ的能量,石墨转化为金刚石要吸收能量,说明石墨的能量低,即石墨比金刚石更稳定,故D正确.
故选D.
点评 本题考查金刚石和石墨的转化以及涉及到的能量变化,题目难度不大,明确物质自身具有能量越低越稳定.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
19.将SO2和X气体分别通入BaCl2溶液,未见沉淀生成,若同时通入,有沉淀生成,则X气体可能是( )
| A. | CO2 | B. | SO3 | C. | C12 | D. | HCl |
20.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素叙述正确的是( )
| A. | 气态氢化物的稳定性:D>C | B. | 原子半径:B>A>C>D | ||
| C. | 单质的还原性:B>A | D. | 原子序数:b>a>c>d |
17.下列烷烃:①异丁烷 ②丙烷 ③正戊烷 ④正丁烷 ⑤甲烷中,沸点由低到高的顺序正确的是( )
| A. | ①②③④⑤ | B. | ⑤③④①② | C. | ③④⑤②① | D. | ⑤②①④③ |
14.银锌钮扣电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为Ag2O+Zn$?_{充电}^{放电}$2Ag+ZnO,在此电池放电时,则下列说法正确的是( )
| A. | 氧化银为正极,被还原 | B. | 银为负极,被氧化 | ||
| C. | Zn为负极,被还原 | D. | 该装置中的电解质为酸性物质 |
19.下列说法正确的是( )
| A. | 25℃时,对于pH相同的弱碱ROH和MOH(前者的电离平衡常数Kb较小),加水稀释后溶液的pH仍相同,则后者稀释的倍数更大 | |
| B. | 25℃时,0.1mol•L-1的HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8,则该溶液中由水电离出的c(H+)=1×10-3mol•L-1 | |
| C. | 25℃时,等物质的量浓度、等体积的NH4HSO4溶液和NaOH溶液混合:c(Na+)=c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) | |
| D. | 25℃时,沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO${\;}_{4}^{2-}$(aq)的Ksp为1.1×10-10,说明BaSO4是弱电解质 |
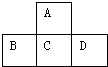 图是周期表的一部分,已知A、B、C、D都是短周期元素,四种元素原子核外共有56个电子,推断A、B、C、D各是什么元素,写出他们的元素符号:AO,BP,CS,DCl.
图是周期表的一部分,已知A、B、C、D都是短周期元素,四种元素原子核外共有56个电子,推断A、B、C、D各是什么元素,写出他们的元素符号:AO,BP,CS,DCl.