题目内容
1.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
⑥混合物水中的18O的物质的量不再变化(本实验所用的乙醇为CH3CH218OH)( )
| A. | ②④⑤⑥ | B. | ①⑤⑥ | C. | ①③⑤ | D. | 全部 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①单位时间里,生成1mol乙酸乙酯,同时生成1mol水,反应都体现正反应方向,未体现正与逆的关系,故不选;
②单位时间里,生成1mol乙酸乙酯,等效消耗1mol乙酸,同时生成1mol乙酸,正逆反应速率相等,故选;
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸,只要反应发生就符合这一关系,故不选;
④正反应的速率与逆反应的速率相等,达平衡状态,故选;
⑤混合物中各物质的浓度不再变化,说明正反应的速率与逆反应的速率相等,达平衡状态,故选;
⑥混合物水中的18O的物质的量不再变化(本实验所用的乙醇为CH3CH218OH),正反应的速率与逆反应的速率相等,达平衡状态,故选;
故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
5.下列气态氢化物的稳定性依次增强的是( )
| A. | SiH4、NH3、HF、CH4 | B. | SiH4、CH4、NH3、HF | C. | HF、CH4、SiH4、NH3 | D. | NH3、HF、CH4、SiH4 |
6.现有一种烃的结构式如图所示,命名该化合物时,应认定它的主链上的碳原子数目是( )

| A. | 9 | B. | 10 | C. | 11 | D. | 12 |
9.2015年12月杭州多日被雾霾笼罩,有报道称雾霾颗粒中汽车尾气占20%以上.已知汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等有害物质.目前,已研究出了多种消除汽车尾气污染的方法.
Ⅰ.在汽车尾气系统中装置催化转化器,可有效降低NOX的排放.已知:
N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:4NO2+O2+2H2O═4HNO3.
(2)尾气转化的反应之一:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5KJ/mol.
(3)已知:N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1,则NO分子中化学键的键能为631.5kJ•mol-1.
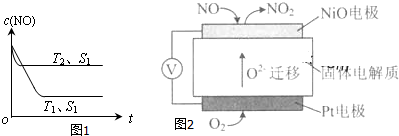
(4)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图1表示在其他条件不变时,反应:2NO(g)+2CO(g)?2CO2(g)+N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.若催化剂的表面积S1>S2,在图1中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线.
Ⅱ.还原法.用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
(1)T1℃时,该反应的平衡常数K=0.56(保留两位小数).
(2)30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减小CO2的浓度.
(3)若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为 5:3:3,则该反应的△H<0(填“>”、“=”或“<”).
Ⅲ.变废为宝.
(1)CO可用于合成CH3OH,反应方程式为:CO(g)+2H2(g)?CH3OH(g),在一定温度压强下(甲醇为气体),在容积为2L的密闭容器中通入0.2molCO与0.4molH2,达平衡时CO的转化率50%,再加入1.0molCO后重新达到平衡,则CO的转化率减小(填“增大”、“不变”或“减小”);
(2)通过NOx传感器可监测NOx的含量,其工作原理示意图如图2:
①Pt电极上发生的是还原反应(填“氧化”或“还原”).
②写出NiO电极的电极反应式:NO+O2--2e-=NO2.
Ⅰ.在汽车尾气系统中装置催化转化器,可有效降低NOX的排放.已知:
N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
2C(s)+O2(g)═2CO(g)△H=-221.0kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:4NO2+O2+2H2O═4HNO3.
(2)尾气转化的反应之一:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5KJ/mol.
(3)已知:N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1,则NO分子中化学键的键能为631.5kJ•mol-1.
(4)当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图1表示在其他条件不变时,反应:2NO(g)+2CO(g)?2CO2(g)+N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.若催化剂的表面积S1>S2,在图1中画出c(NO) 在T1、S2条件下达到平衡过程中的变化曲线.
Ⅱ.还原法.用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
(2)30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是减小CO2的浓度.
(3)若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为 5:3:3,则该反应的△H<0(填“>”、“=”或“<”).
Ⅲ.变废为宝.
(1)CO可用于合成CH3OH,反应方程式为:CO(g)+2H2(g)?CH3OH(g),在一定温度压强下(甲醇为气体),在容积为2L的密闭容器中通入0.2molCO与0.4molH2,达平衡时CO的转化率50%,再加入1.0molCO后重新达到平衡,则CO的转化率减小(填“增大”、“不变”或“减小”);
(2)通过NOx传感器可监测NOx的含量,其工作原理示意图如图2:
①Pt电极上发生的是还原反应(填“氧化”或“还原”).
②写出NiO电极的电极反应式:NO+O2--2e-=NO2.

6.某同学用下列装置制备并检验Cl2的性质:

下列说法正确的是( )

下列说法正确的是( )
| A. | Ⅰ图中:如果MnO2过量,浓盐酸就可全部消耗完 | |
| B. | Ⅱ图中:有棕黄色的雾生成 | |
| C. | Ⅲ图中:量筒中发生了加成反应 | |
| D. | Ⅳ图中湿润的有色布条能褪色,将浓硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
10.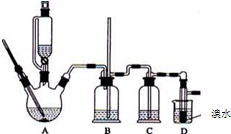 实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
有关数据列表如下:
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)装置B的作用是防止倒吸.
(3)在装置C中应加入c (填字母),其目的是除去CO2、SO2等酸性气体.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量未反应的Br2,最好用e(填字母)洗涤除去.
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
发生的化学反应离子方程式为Br2+SO32-+H2O═SO42-+2Br-+2H+;
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去.
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是冷却可避免溴的大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
(7)判断该制备反应已经结束的最简单方法是D中溴水完全褪色.
 实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
(1)烧瓶A中发生的主要的反应方程式CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
(2)装置B的作用是防止倒吸.
(3)在装置C中应加入c (填字母),其目的是除去CO2、SO2等酸性气体.
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量未反应的Br2,最好用e(填字母)洗涤除去.
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
发生的化学反应离子方程式为Br2+SO32-+H2O═SO42-+2Br-+2H+;
(5)若产物中有少量副产物乙醚,可用蒸馏的方法除去.
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是冷却可避免溴的大量挥发;1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
(7)判断该制备反应已经结束的最简单方法是D中溴水完全褪色.
11.对NaNO3分类,不正确的是( )
| A. | 属于钠盐 | B. | 属于硝酸盐 | C. | 属于正盐 | D. | 属于酸式盐 |
 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下: