题目内容
19.下列说法不正确的是( )| A. | 蒸发结晶时,当加热至蒸发皿中有大量固体析出时应停止加热,利用余热蒸干剩余溶液 | |
| B. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 | |
| C. | 将过氧化钠固体投入紫色石蕊溶液中,可看到石蕊溶液变蓝 | |
| D. | 用原子吸收光谱可以确定物质中含有哪些金属元素 |
分析 A.当蒸发皿中出现较多固体时,应该停止加热,剩余液体利用余热蒸干即可;
B.二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化生成硫酸根离子,二氧化碳和酸性高锰酸钾溶液、浓硫酸都不反应,浓硫酸具有吸水性;
C.过氧化钠具有强氧化性,能氧化石蕊试液,过氧化钠和水反应生成NaOH而使溶液呈碱性,紫色石蕊试液遇碱变蓝色;
D.原子吸收光谱是基于气态的基态原子外层电子对紫外光和可见光范围的相对应原子共振辐射线的吸收强度来定量被测元素含量为基础的分析方法.
解答 解:A.蒸发时,不能将滤液蒸干,否则会导致固体四溅,容易发生危险,应该在蒸发皿中具有较多固体时停止加热,利用余热将液体蒸干即可,故A正确;
B.二氧化硫具有还原性,能被酸性高锰酸钾溶液氧化生成硫酸根离子,二氧化碳和酸性高锰酸钾溶液、浓硫酸都不反应,浓硫酸具有吸水性,所以除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶,从而达到除杂和干燥目的,故B正确;
C.过氧化钠具有强氧化性,能氧化石蕊试液,过氧化钠和水反应生成NaOH而使溶液呈碱性,紫色石蕊试液遇碱变蓝色,所以将过氧化钠固体投入紫色石蕊溶液中,可看到石蕊溶液先变蓝色后褪色,故C错误;
D.原子吸收光谱是基于气态的基态原子外层电子对紫外光和可见光范围的相对应原子共振辐射线的吸收强度来定量被测元素含量为基础的分析方法,故D正确;
故选C.
点评 本题考查物质分离和提纯、物质性质、金属元素判断等知识点,为高频考点,侧重考查基本操作、物质性质等知识点,明确实验原理、实验基本操作方法、物质性质是解本题关键,注意过氧化钠的漂白作用,易错选项是C.

练习册系列答案
相关题目
9.短周期元素A、B、C、D、E的原子序数依次增大;A的一种核素在考古时常用来鉴定一些文物的年代,B的氢化物的水溶液呈碱性;C、D为金属元素,且D原子最外层电子数等于其K层电子数,而C的阳离子半径大于D的阳离子半径;若往E单质的水溶液中滴加少量紫色石蕊试液,能观察到先变红后褪色的现象.下列说法中正确的是( )
| A. | B的氢化物和E的氢化物能反应,且得到的产物只含有共价键 | |
| B. | C在元素周期表中的位置是第三周期第ⅠA族 | |
| C. | 五种原子中E的原子半径最大 | |
| D. | A的最低价氢化物的沸点>B的最低价氢化物的沸点 |
10.化学方程式可简明地体现元素及其化合物的性质.已知:氧化还原反应:
2FeCl3+2HI═2FeCl2+I2+2HCl; 2Co(OH)3+6HCl═2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH═2Fe(OH)3+2KI; 3I2+6KOH═5KI+KIO3+3H2O
复分解反应:2HSCN+K2CO3═2KSCN+CO2↑+H2O; KCN+CO2+H2O═HCN+KHCO3
热分解反应:4NaClO$\frac{\underline{\;\;△\;\;}}{\;}$3NaCl+NaClO4;NaClO4 $\frac{\underline{\;\;△\;\;}}{\;}$NaCl+2O2↑下列说法不正确是( )
2FeCl3+2HI═2FeCl2+I2+2HCl; 2Co(OH)3+6HCl═2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH═2Fe(OH)3+2KI; 3I2+6KOH═5KI+KIO3+3H2O
复分解反应:2HSCN+K2CO3═2KSCN+CO2↑+H2O; KCN+CO2+H2O═HCN+KHCO3
热分解反应:4NaClO$\frac{\underline{\;\;△\;\;}}{\;}$3NaCl+NaClO4;NaClO4 $\frac{\underline{\;\;△\;\;}}{\;}$NaCl+2O2↑下列说法不正确是( )
| A. | 氧化性(酸性溶液):Co(OH)3>FeCl3>I2 | B. | 还原性(碱性溶液):I2>Fe(OH)2>KIO3 | ||
| C. | 热稳定性:NaCl>NaClO4>NaClO | D. | 酸性(水溶液):HSCN>H2CO3>HCN |
7.下列有关物质结构的说法正确的是( )
| A. | 第三周期非金属元素氧化物水化物的酸性从左到右依次增强 | |
| B. | 水加热到很高的温度都难以分解是因为水分子间存在氢键 | |
| C. | 同主族元素从上到下,单质的熔点逐渐降低 | |
| D. | 元素的种类由核内质子数决定 |
4.进行化学实验时应强化安全意识.下列做法正确的是( )
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 加热碳酸氢钠固体时使试管竖直向上 | |
| C. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| D. | 实验室制取少量的氯气,在通风橱内进行 |
11.将赤铜矿(Cu2O)与辉铜矿(Cu2S)混合加热发生以下反应:Cu2S+2Cu2O $\frac{\underline{\;\;△\;\;}}{\;}$ 6Cu+SO2↑,下列说法错误的是( )
| A. | 在Cu2O、Cu2S中Cu元素化合价都是+1价 | |
| B. | 反应中Cu元素被氧化,S元素被还原 | |
| C. | Cu2S在反应中既是氧化剂,又是还原剂 | |
| D. | 每生成6.4g Cu,反应中转移0.1 mole- |
8.将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL4.40mol/L盐酸中,充分反应后产生0.04mol H2,残留固体1.28g.过滤,滤液中无Cu2+,测得滤液中n(H+)为0.08mol.则原混合物中单质铁的质量是( )
| A. | 2.24g | B. | 3.36g | C. | 5.60g | D. | 10.08g |
16.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1molNa2O2固体中含离子总数为4NA | |
| B. | 0.1mol/L的AgNO3溶液中,阳离子所带正电荷数目为0.1NA | |
| C. | 标准状况下,22.4LSO3所含分子数为NA | |
| D. | 23g钠在氧气中完全燃烧失电子数为NA |

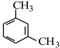 ;
;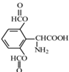 、
、 ;
; +CH3CH=CH2$\stackrel{AlCl_{3}}{→}$
+CH3CH=CH2$\stackrel{AlCl_{3}}{→}$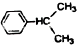 结合相关信息,请写出以
结合相关信息,请写出以 、CH2=CH2和
、CH2=CH2和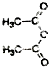 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).