题目内容
7.下列有关物质结构的说法正确的是( )| A. | 第三周期非金属元素氧化物水化物的酸性从左到右依次增强 | |
| B. | 水加热到很高的温度都难以分解是因为水分子间存在氢键 | |
| C. | 同主族元素从上到下,单质的熔点逐渐降低 | |
| D. | 元素的种类由核内质子数决定 |
分析 A、非金属性强,最高价氧化物对应的水化物的酸性强;
B、物质的稳定性与键能的大小有关;
C、根据卤族元素自上而下单质熔沸点升高,碱金属自上而下单质熔沸点降低;
D、元素是具有相同核电荷数(质子数)一类原子的总称,所以核内质子数决定了元素的种类;
解答 解:A、非金属性强,最高价氧化物对应的水化物的酸性强,则同周期非金属最高价氧化物对应的水化物的酸性从左到右依次增强,而低价氧化物的酸性无此规律,故A错误;
B、H2O较稳定是由于H-O键键能较大,与氢键无关,故B错误;
C、卤族元素自上而下单质熔沸点升高,碱金属自上而下单质熔沸点降低,所以同主族元素的单质的熔点从上到下不一定逐渐升高,故C错误;
D、元素是具有相同核电荷数(质子数)一类原子的总称,所以核内质子数决定了元素的种类,故D正确;
故选D.
点评 本题考查同周期元素性质递变规律和差异性,比较基础,注意元素的种类由核内质子数决定.

练习册系列答案
相关题目
17.下列中学常见实验的现象或表述正确的是( )
| A. | 赤铁矿的主要成分是Fe3O4 | |
| B. | 制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁 | |
| C. | 检验红砖中的氧化铁成分,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴即可 | |
| D. | 除去FeCl3溶液中的FeCl2杂质可以向溶液中加入足量的铁粉,然后过滤 |
18.下列与金属腐蚀有关的说法正确的是( )
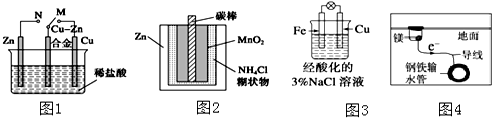

| A. | 图1中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小 | |
| B. | 图2中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 | |
| C. | 图3中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现 | |
| D. | 图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极 |
15.工业上用乙烯水合法制取乙醇,其反应为:C2H4(g)+H2O(g)C2H5OH(g)△H=a kJ•mol-1.将等物质的量的C2H4(g)和H2O(g)充入某装置制取乙醇,乙烯的平衡转化率随温度、压强的变化关系如图所示.(平衡时,可用气体分压代替平衡浓度计算平衡常数,气体分压=气体总压×体积分数)

下列说法正确的是( )

下列说法正确的是( )
| A. | a大于0,P1小于P2 | |
| B. | M点H2O(g)的转化率为10% | |
| C. | M点化学反应速率大于N点 | |
| D. | 250℃时,用平衡分压计算的化学平衡常数 KP=$\frac{9}{16}$ |
2.下列有关分类的说法正确的是( )
| A. | 胶体的本质特征是具有丁达乐效应 | |
| B. | 阳离子、阴离子中均分别只含有一种元素,则由这样的阴、阳离子组成的物质一定是纯净物 | |
| C. | 白磷转化为红磷是物理变化 | |
| D. | 碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物 |
12. 酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、NH4Cl等组成的糊状填充物,其结构如下图.该电池在放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、NH4Cl等组成的糊状填充物,其结构如下图.该电池在放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
回收处理该废旧电池可以得到多种化工原料,有关数据下图所示:溶解度/(g/100g水)
某化学课外小组设计了如下废旧电池综合利用工艺(不考虑废旧电池中实际存在的少量其他金属):

回答下列问题:
(1)该酸性锌锰干电池放电时的正极反应式为MnO2+e-+NH4+=MnOOH+NH3;
(2)晶体A的化学式为NH4Cl;
(3)操作③的名称为在空气中灼烧;
(4)从MnO2获得K2MnO4的反应方程式为3MnO2+KClO3+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O;
(5)用废电池的锌皮制作ZnSO4•7H2O,需去除少量杂质铁,其方法是:
①加入足量的稀H2SO4和H2O2溶解.加入H2O2反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O;
②加碱调节pH为3,使铁刚好完全沉淀,过滤.向滤液中继续加碱调节pH使锌刚好完全沉淀.过滤、洗涤.
③将沉淀溶于稀H2SO4,经过蒸发浓缩、冷却结晶(答操作名称)、过滤、洗涤、干燥得到ZnSO4•7H2O,晶体用冷水洗涤的原因是降低晶体的溶解度,减少损失.
 酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、NH4Cl等组成的糊状填充物,其结构如下图.该电池在放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH
酸性锌锰干电池是一种一次性电池,外壳为金属锌,中间是碳棒,其周围是有碳粉、MnO2、NH4Cl等组成的糊状填充物,其结构如下图.该电池在放电时发生的主要反应为:Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl2+2MnOOH回收处理该废旧电池可以得到多种化工原料,有关数据下图所示:溶解度/(g/100g水)
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |

回答下列问题:
(1)该酸性锌锰干电池放电时的正极反应式为MnO2+e-+NH4+=MnOOH+NH3;
(2)晶体A的化学式为NH4Cl;
(3)操作③的名称为在空气中灼烧;
(4)从MnO2获得K2MnO4的反应方程式为3MnO2+KClO3+6KOH$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O;
(5)用废电池的锌皮制作ZnSO4•7H2O,需去除少量杂质铁,其方法是:
①加入足量的稀H2SO4和H2O2溶解.加入H2O2反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O;
②加碱调节pH为3,使铁刚好完全沉淀,过滤.向滤液中继续加碱调节pH使锌刚好完全沉淀.过滤、洗涤.
③将沉淀溶于稀H2SO4,经过蒸发浓缩、冷却结晶(答操作名称)、过滤、洗涤、干燥得到ZnSO4•7H2O,晶体用冷水洗涤的原因是降低晶体的溶解度,减少损失.
19.下列说法不正确的是( )
| A. | 蒸发结晶时,当加热至蒸发皿中有大量固体析出时应停止加热,利用余热蒸干剩余溶液 | |
| B. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 | |
| C. | 将过氧化钠固体投入紫色石蕊溶液中,可看到石蕊溶液变蓝 | |
| D. | 用原子吸收光谱可以确定物质中含有哪些金属元素 |
4.下列叙述正确的是( )
| A. | 镁铝合金的抗腐蚀能力强,不与稀硫酸反应 | |
| B. | Na的金属活动性比Mg的强,故可用Na与MgCl2溶液反应制Mg | |
| C. | 钠可与冷水剧烈反应,而镁与热水才能反应,说明钠比镁活泼 | |
| D. | Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中,Fe也显+3价 |