题目内容
16.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )| A. | 1molNa2O2固体中含离子总数为4NA | |
| B. | 0.1mol/L的AgNO3溶液中,阳离子所带正电荷数目为0.1NA | |
| C. | 标准状况下,22.4LSO3所含分子数为NA | |
| D. | 23g钠在氧气中完全燃烧失电子数为NA |
分析 A、过氧化钠由2个钠离子和1个过氧根构成;
B、溶液体积不明确;
C、标况下三氧化硫为固体;
D、求出钠的物质的量,然后根据反应后钠元素为+1价来分析.
解答 解:A、过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠中含3mol离子即3NA个,故A错误;
B、溶液体积不明确,故溶液中的阳离子的个数无法计算,故B错误;
C、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量和分子个数,故C错误;
D、23g钠的物质的量为1mol,而反应后钠元素为+1价,故1mol钠转移1mol电子即NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
19.下列说法不正确的是( )
| A. | 蒸发结晶时,当加热至蒸发皿中有大量固体析出时应停止加热,利用余热蒸干剩余溶液 | |
| B. | 除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶 | |
| C. | 将过氧化钠固体投入紫色石蕊溶液中,可看到石蕊溶液变蓝 | |
| D. | 用原子吸收光谱可以确定物质中含有哪些金属元素 |
20.将一定质量的锌、氧化铁、氧化铜的混合物粉末放入100mL4.4mol/L盐酸中,充分反应后产生896mL H2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+,将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L.则原混合物中单质锌的质量是( )
| A. | 2.60g | B. | 3.90g | C. | 6.50g | D. | 13.65g |
4.下列叙述正确的是( )
| A. | 镁铝合金的抗腐蚀能力强,不与稀硫酸反应 | |
| B. | Na的金属活动性比Mg的强,故可用Na与MgCl2溶液反应制Mg | |
| C. | 钠可与冷水剧烈反应,而镁与热水才能反应,说明钠比镁活泼 | |
| D. | Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中,Fe也显+3价 |
11.下列物质①NaOH、②氯水、③空气、④氢硫酸、⑤Na2SO3、⑥Na2CO3,其中能与SO2在一定条件下发生反应的是( )
| A. | ①②④⑤ | B. | ②④⑤⑥ | C. | ②③④⑤ | D. | 全部 |
1.常温时,将下列溶液等体积混合后,所得混合液的pH小于7的是( )
| A. | pH为2的醋酸溶液与pH为12的氢氧化钠溶液 | |
| B. | 0.0l mol•L-1 的醋酸溶液与0.01 mol•L-1的氢氧化钠溶液 | |
| C. | pH为2的硫酸溶液与pH为12的氢氧化钠溶液 | |
| D. | 0.010 mol•L-1的盐酸溶液与0.010 mol•L-1的氢氧化钡溶液 |
6.下列各组离子,可以形成无色透明碱性溶液的是( )
| A. | K+、NH4+、OH-、NO3- | B. | Mg2+、Na+、AlO2-、OH- | ||
| C. | Na+、Ba2+、OH-、SO42- | D. | Cu2+、Al3+、SO42-、Cl- |

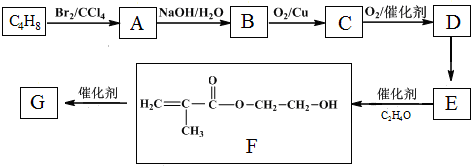
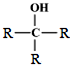 $\stackrel{O_{2}/Cu}{→}$不能被氧化
$\stackrel{O_{2}/Cu}{→}$不能被氧化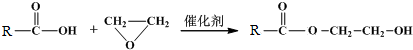
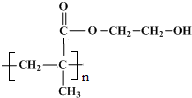 .
.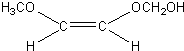 、
、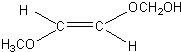 、
、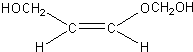 、
、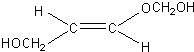 .
.