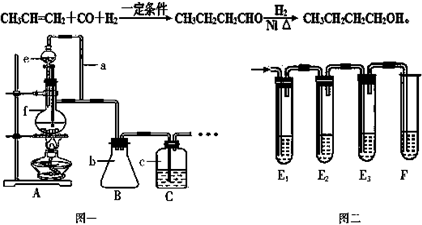
题目内容
18.欲将反应2Fe3++Cu═Cu2++2Fe2+设计成原电池,该电池负极材料为Cu,电解质溶液为氯化铁溶液,正极反应为Fe3++e-═Fe2+,10min内该电池向外提供0.1mol电子,则正极材料与负极材料的质量差为3.2g(假设刚开始时,两电极的质量相等).分析 根据电池反应式知,Cu失电子发生氧化反应,则作负极,不如Cu活泼的金属或导电的非金属作正极,含有铁离子的可溶性铁盐溶液为电解质溶液,根据转移电子与Cu的关系式计算消耗Cu的质量,由此分析解答.
解答 解:根据电池反应式知,Cu失电子发生氧化反应,则作负极,不如Cu活泼的金属或导电的非金属作正极,正极电极反应式为:Fe3++e-═Fe2+,含有铁离子的可溶性铁盐溶液为电解质溶液,如FeCl3溶液;负极反应式为Cu-2e-=Cu2+,负极上铜失电子生成铜离子进入溶液,所以铜质量在不断减少,根据转移电子与Cu的关系式得消耗Cu的质量=$\frac{0.1mol}{2}$×64g/mol=3.2g;故答案为:Cu;氯化铁溶液;Fe3++e-═Fe2+;3.2.
点评 本题考查原电池设计,侧重考查学生设计及计算能力,会根据得失电子确定原电池正负极、电解质溶液,失电子的金属作负极、得电子的可溶性电解质溶液为该原电池电解质溶液,题目难度不大.

练习册系列答案
相关题目
6.乙醇汽油是用普通汽油与燃料乙醇调和而成,它可以有效改善油的性能和质量,降低一氧化碳、碳氢化合物等主要污染物的排放.1mol乙醇完全燃烧生成液态水和二氧化碳气体放出23.5kJ热量,燃烧1mol这种汽油生成液态水,放出的热量为Q kJ.测得该汽油中乙醇与汽油的物质的量之比为1:9.有关普通汽油(CxHy)燃烧的热化学方程式正确的一项是( )
| A. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-Q+23.5)kJ•mol-1 | |
| B. | CxHy(l)+( x+$\frac{y}{4}$)O2═xCO2+$\frac{y}{2}$H2O(l)△H=?-$\frac{9Q}{10}$?kJ•mol-1 | |
| C. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=-$\frac{9Q}{10}$ kJ•mol-1 | |
| D. | CxHy(l)+( x+$\frac{y}{4}$)O2(g)═xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+2.61)kJ•mol-1 |
13.化学反应速率受条件的影响很大,下列肯定可以加快化学反应速率的措施( )
| A. | 使用负催化剂 | B. | 改变浓度 | C. | 降低温度 | D. | 升高温度 |
3.下列变化过程中,没有破坏化学键的是( )
| A. | 氧气溶于水 | B. | 碳的燃烧 | C. | 氯气与氢气反应 | D. | 水的通电分解 |
10.某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果不正确的是( )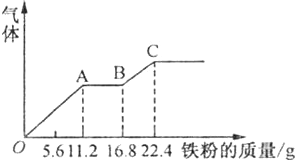

| A. | 图中,AB段的反应为Fe+2Fe 3+=3Fe 2+,溶液中溶质最终为FeSO 4 | |
| B. | 原溶液中H2SO4浓度为2.5mol•L -1 | |
| C. | 原混合溶液中NO3-的物质的量为0.4mol | |
| D. | 图中,OA段产生的气体是NO,BC段产生的气体是氢气 |
7.下列溶液中的Cl-的浓度与100mL l.5mol•L-1CaCl2溶液中的Cl-的浓度相等的是( )
| A. | 150 mL 1.5 mo1•L-1NaCl溶液 | B. | 75 mL 3 mol•L-1MgCl2溶液 | ||
| C. | 150 mL 2 mo1•L-1KCl溶液 | D. | 75 mL 1 mol•L-1A1C13溶液 |
8.下列树脂在一定条件下不能制成塑料的是( )
| A. | 聚乙烯 | B. | 聚氯乙烯 | C. | 酚醛树脂 | D. | 聚四氟乙烯 |
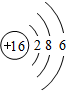 ,G元素形成的单质的结构式为Cl-Cl.
,G元素形成的单质的结构式为Cl-Cl. .
. .
.