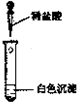
题目内容
 甲、乙、丙、丁、戊五种前四周期元素,其中甲乙丙都为非金属元素,在周期表中的位置关系如图1所示.丁、戊两种元素则位于同一周期同一族,而且戊的原子序数比丁大2.
甲、乙、丙、丁、戊五种前四周期元素,其中甲乙丙都为非金属元素,在周期表中的位置关系如图1所示.丁、戊两种元素则位于同一周期同一族,而且戊的原子序数比丁大2.(1)甲、乙、丙三种元素电负性由大到小为
(填元素符号)
(2)乙的氢化物
(3)丙的价电子排布式为
(4)过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合18电子规则.如Cr可以与CO形成Cr(CO)6分子:价电子总数(18)=Cr的价电子数(6)+CO提供电子数(2×6)(提示:每个CO配体提供2个电子)丁、戊两种原子都能与CO形成配合物,其化学式分别为
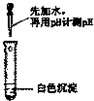
(5)丁的晶胞如图2所示,已知丁相对原子质量为M,晶体密度ρ g?cm-3,阿伏伽德罗常数为NA,
丁元素的原子半径为
(用M、ρ、NA表示,不用化简)
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:甲、乙、丙、丁、戊五种前四周期元素,其中甲乙丙都为非金属元素,在周期表中的位置关系如图1所示,则甲为氟元素、乙为硫元素,丙为砷元素,丁、戊两种元素则位于同一周期同一族,则它们是第ⅤⅢ族元素,而且戊的原子序数比丁大2,所以戊为镍元素,丁为铁元素,据此答题.
解答:
解:甲、乙、丙、丁、戊五种前四周期元素,其中甲乙丙都为非金属元素,在周期表中的位置关系如图1所示,则甲为氟元素、乙为硫元素,丙为砷元素,丁、戊两种元素则位于同一周期同一族,则它们是第ⅤⅢ族元素,而且戊的原子序数比丁大2,所以戊为镍元素,丁为铁元素,
(1)根据元素周期律,氟、硫、砷的电负性由大到小为F>S>As,故答案为:F>S>As;
(2)硫化氢不能形成氢键,因为S原子半径太大,电负性不够强,难以形成氢键,故答案为:不能;S原子半径太大,电负性不够强,难以形成氢键;
(3)丙为砷元素,它有5个价电子,电子排布式为4s24p3,故答案为:4s24p3;
(4)丁为铁元素,价电子数为8,根据18电子规则,它可以结合5个CO形成配合物,戊为镍元素,价电子数为10,根据18电子规则,它可以结合4个CO形成配合物,所以这两种元素形成的配合物的化学式分别为Fe(CO)5、Ni(CO)4,故答案为:Fe(CO)5、Ni(CO)4;
(5)丁为铁元素,根据晶胞结构可知,每个晶胞中含有8×
+1=2个铁原子,根据v=
可得,晶胞的边长为
cm,根据晶胞的结构可知,铁的原子半径为晶胞边长的
,所以铁原子的半径为
×
cm,故答案为:
×
;
(1)根据元素周期律,氟、硫、砷的电负性由大到小为F>S>As,故答案为:F>S>As;
(2)硫化氢不能形成氢键,因为S原子半径太大,电负性不够强,难以形成氢键,故答案为:不能;S原子半径太大,电负性不够强,难以形成氢键;
(3)丙为砷元素,它有5个价电子,电子排布式为4s24p3,故答案为:4s24p3;
(4)丁为铁元素,价电子数为8,根据18电子规则,它可以结合5个CO形成配合物,戊为镍元素,价电子数为10,根据18电子规则,它可以结合4个CO形成配合物,所以这两种元素形成的配合物的化学式分别为Fe(CO)5、Ni(CO)4,故答案为:Fe(CO)5、Ni(CO)4;
(5)丁为铁元素,根据晶胞结构可知,每个晶胞中含有8×
| 1 |
| 8 |
| ||
| ρ |
| 3 |
| ||
| ||
| 4 |
| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
点评:本题主要考查了电负性、氢化物的稳定性、配合物、晶胞的计算等知识点,中等难度,解题关键在于根据元素在周期表中的位置,确定元素种类.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在一定体积的18mol/L的浓硫酸中加入过量铜片并加热,被还原的硫酸为0.9mol,则浓H2SO4的实际体积( )
| A、等于50mL |
| B、大于50mL |
| C、等于100mL |
| D、大于100mL |
制取新型水处理剂CO2的化学方程式为:2KClO3+H2C2O4+H2SO4
2ClO2+K2SO4+2CO2+2H2O.下列说法不正确的是( )
| ||
| A、KClO3在反应中得到电子 |
| B、1mol KClO3参加反应有2mol电子转移 |
| C、H2C2O4在反应中被氧化 |
| D、ClO2是还原产物 |
下列化学方程式或离子方程式正确的是( )
| A、乙酸与碳酸钠溶液反应:2H++CO32-=CO2↑+H2O | ||
B、甲醛与足量新制Cu(OH)2浊液反应:HCHO+2Cu(OH)2
| ||
C、实验室用液溴和苯在催化剂作用下制溴苯: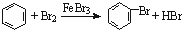 | ||
D、将CO2通入苯酚钠溶液: |
下列说法正确的是( )
| A、CO2的水溶液能导电,所以CO2是电解质 |
| B、BaSO4不溶于水,其水溶液很难导电,所以BaSO4是非电解质 |
| C、液氯不导电,所以液氯是非电解质 |
| D、氯化氢的水溶液能导电,所以氯化氢是电解质 |