题目内容
现有A、B、C、D四种元素,A、B两元素的原子内各有两个电子层,C、D两元素均位于第三周期,A、B能化合成无色无味气体AB2,C、D能形成离子化合物CD,B和D同主族,B离子和C离子核外电子数相等.则:
(1)A、B、C、D分别是 、 、 、 ;
(2)由上述四种元素中的两种元素形成的离子(原子数不超过6)水解呈碱性的有
① ② ③ ④ .
(1)A、B、C、D分别是
(2)由上述四种元素中的两种元素形成的离子(原子数不超过6)水解呈碱性的有
①
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D四种元素,A和B两种元素的原子各有两个电子层,C、D两元素均位于第三周期;
A和B能化合生成无色无味的气体AB2,则A位于第IVA族、B位于第VIA族,则A为C元素、B为O元素;B和D是同族元素,则D是S元素;
C、D能形成离子化合物CD,则C的化合价为+1价,C位于第IA族,B离子和C离子核外电子数相同,则C是Na元素.
A和B能化合生成无色无味的气体AB2,则A位于第IVA族、B位于第VIA族,则A为C元素、B为O元素;B和D是同族元素,则D是S元素;
C、D能形成离子化合物CD,则C的化合价为+1价,C位于第IA族,B离子和C离子核外电子数相同,则C是Na元素.
解答:
解:A、B、C、D四种元素,A和B两种元素的原子各有两个电子层,C、D两元素均位于第三周期;A和B能化合生成无色无味的气体AB2,则A位于第IVA族、B位于第VIA族,则A为C元素、B为O元素;B和D是同族元素,则D是S元素;C、D能形成离子化合物CD,则C的化合价为+1价,C位于第IA族,B离子和C离子核外电子数相同,则C是Na元素,
(1)通过以上分析知:A、B、C、D分别是C、O、Na、S元素,故答案为:C;O;Na;S;
(2)A、B、C、D分别是C、O、Na、S元素,该四种元素中的两种元素形成的离子(原子数不超过6)水解呈碱性,则该离子为弱酸根粒子,常见的满足条件的离子有:S2-、SO32-、CO32-、HCO3-,
故答案为:S2-;SO32-;CO32-;HCO3-.
(1)通过以上分析知:A、B、C、D分别是C、O、Na、S元素,故答案为:C;O;Na;S;
(2)A、B、C、D分别是C、O、Na、S元素,该四种元素中的两种元素形成的离子(原子数不超过6)水解呈碱性,则该离子为弱酸根粒子,常见的满足条件的离子有:S2-、SO32-、CO32-、HCO3-,
故答案为:S2-;SO32-;CO32-;HCO3-.
点评:本题考查了原子结构和元素性质,题目难度中等,涉及元素推断、盐的水解等知识,正确推断各元素名称为解答关键,注意掌握盐的水解原理、元素周期表结构及元素周期律内容.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
某同学测得物质的量浓度均为0.01mol/LCH3COOH和CH3COONa混合溶液呈酸性后,得出了关系式,你认为其中不正确的是( )
| A、c(CH3COO-)>c(CH3COOH) |
| B、c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C、c(Na+)=c(CH3COO-)=0.01mol/L |
| D、c(CH3COOH)+c(CH3COO-)=0.01mol/L |
由苯乙烯和羟基乙酸乙酯(HO-CH2-COOCH2CH3)组成的混合物中,若碳元素的质量分数为70%,那么氢元素的质量分数约为( )
| A、4.6% | B、7.7% |
| C、15.6% | D、无法计算 |
用浓H2SO4跟分子式分别为C2H6O和C3H8O的醇的混合液反应,可得到醚的种类有( )
| A、1种 | B、3种 | C、5种 | D、6种 |
某一元醛发生银镜反应,生成金属银4.32g,等量该醛完全燃烧后,可生成水1.08g.则此醛可以是下列中的( )
| A、丙醛 | B、丙烯醛 | C、丁醛 | D、乙醛 |
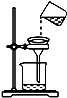 现有含NaCl、MgCl2和Na2SO4的混合溶液,某兴趣小组的同学欲提取纯净的NaCl晶体,设计了如下实验:
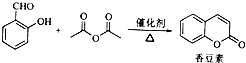
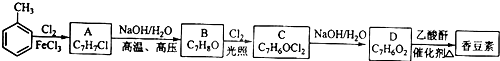
现有含NaCl、MgCl2和Na2SO4的混合溶液,某兴趣小组的同学欲提取纯净的NaCl晶体,设计了如下实验: ),是一种重要的有机化工原料.
),是一种重要的有机化工原料.