题目内容
8.下列实验所对应的离子方程式正确的是( )| A. | 氢氧化铁与氢碘酸反应:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| C. | FeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2++4Cl- | |
| D. | 向FeCl2溶液中加入少量K3[Fe(CN)6]溶液:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ |
分析 A.三价铁离子具有强的氧化性,能够氧化碘离子生成单质碘;
B.向沸水中滴加饱和的氯化铁溶液得到氢氧化铁胶体;
C.氯气足量二价铁离子、溴离子都被氧化;
D.含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀.
解答 解:A.氢氧化铁与氢碘酸反应,离子方程式:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,故A错误;
B.向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O═Fe(OH)3(胶体)+3H+,故B错误;
C.向FeBr2溶液中通入足量氯气,亚铁离子和溴离子完全被氧化,反应的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故C错误;
D.含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀,[Fe(CN)6]3-离子带有3个单位负电荷,正确的离子方程式为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓,故D正确;
故选:D.
点评 本题考查了离子方程式的正误判断,为高考中的高频题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法是解题关键,侧重考查氧化还原反应离子方程式书写的考查.

练习册系列答案
相关题目
18.下列元素在自然界中仅以化合态存在的是( )
①Si ②Al ③Cl ④Fe ⑤Na.
①Si ②Al ③Cl ④Fe ⑤Na.
| A. | ①②⑤ | B. | ①② | C. | ①②③ | D. | ①②③⑤ |
19.在分子 中,在同一平面内的碳原子最少应有( )
中,在同一平面内的碳原子最少应有( )
 中,在同一平面内的碳原子最少应有( )
中,在同一平面内的碳原子最少应有( )| A. | 7个 | B. | 8个 | C. | 9个 | D. | 14个 |
3.使用SNCR脱硝技术的主反应为:
4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g);△H
4N2(g)+6H2O(g);△H
副反应及773K时平衡常数如表所示
(1)主反应△H=-1632.5kJ•mol-1,773K时主反应平衡常数K=4.6×1043L•mol-1
(2)图2表示在密闭体系中进行实验,起始投入一定量NH3、NO、O2,测定不同温度下,在相同时间内各组分的浓度.
①图中a、b、c三点,主反应速率最大的是c
②试解释N2浓度曲线先上升后下降的原因先上升:反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓度越大;后下降:达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动,且随温度升高有副产物的生成,N2浓度降低.
③550K时,欲提高N2O的百分含量,应采取的措施是采用合适的催化剂
(3)电化学催化净化NO是一种最新脱硝方法.原理示意图如图1,固体电解质起到传导O2-的作
用.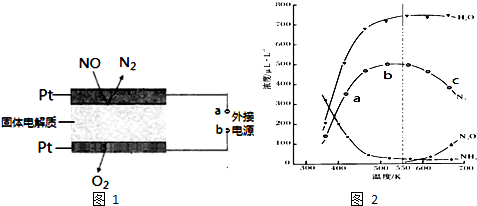
A为外接电源的负极(填“正”、“负”).通入NO的电极反应式为2NO+4e-=N2+2O2-.
4NH3(g)+4NO(g)+O2(g)
 4N2(g)+6H2O(g);△H
4N2(g)+6H2O(g);△H副反应及773K时平衡常数如表所示
| 反应 | △H(kJ•mol-1) | 平衡常数(K) |
| 4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g) | -905.5 | 1.1×1026mol•L-1 |
| 4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g) | -1104.9 | 4.4×1028 |
| 4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g) | -1269.0 | 7.1×1034L•mol-1 |
(2)图2表示在密闭体系中进行实验,起始投入一定量NH3、NO、O2,测定不同温度下,在相同时间内各组分的浓度.
①图中a、b、c三点,主反应速率最大的是c
②试解释N2浓度曲线先上升后下降的原因先上升:反应还未到达平衡状态,温度越高,化学反应速率越快,单位时间内N2浓度越大;后下降:达到平衡状态后,随着温度升高,因反应正向放热,平衡逆向移动,且随温度升高有副产物的生成,N2浓度降低.
③550K时,欲提高N2O的百分含量,应采取的措施是采用合适的催化剂
(3)电化学催化净化NO是一种最新脱硝方法.原理示意图如图1,固体电解质起到传导O2-的作
用.

A为外接电源的负极(填“正”、“负”).通入NO的电极反应式为2NO+4e-=N2+2O2-.
13.下列说法不正确的是( )
| A. | 用加热法可除去Na2CO3中的NaHCO3 | |
| B. | 硝酸酸化的硝酸银溶液检验Cl- | |
| C. | 可用石灰水区分Na2CO3与NaHCO3溶液 | |
| D. | 热纯碱溶液可除去油污 |
20.下列电解质在溶解或熔化时,没有电离出Cl-的是( )
| A. | 盐酸 | B. | 熔化的氯化钠 | C. | KClO3溶液 | D. | NaCl溶液 |
17.有A、B、C、D四种金属,将A与B用导线联结起来,浸入电解质溶液中,B不易腐蚀.将A、D分别投入等物质的量浓度盐酸中,D比A反应剧烈.将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
| A. | A>D>B>C | B. | D>A>B>C | C. | D>A>C>B | D. | C>B>A>D |
18.对Na、Mg、Al的有关性质的叙述正确的是( )
| A. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | B. | 原子半径:Na<Mg<Al | ||
| C. | 金属性:Na<Mg<Al | D. | 单质的还原性:Al>Mg>Na |
 太阳能电池常用材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池常用材料除单晶硅,还有铜铟镓硒等化合物.