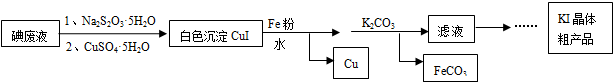
题目内容
10.T℃时,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),发生反应:2SO2(g)+O2(g)?2SO3(g),5min时甲达到平衡.其起始量及SO2的平衡转化率如表所示.下列叙述不正确的是( )| 容器 | 甲 | 乙 | 丙 | |
| 起始量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率 | 80% | α1 | α2 | |
| A. | 0~5min内,甲中SO2的反应速率为0.032mol•L-1•min-1 | |
| B. | T℃时,该反应的平衡常数K=400 | |
| C. | 平衡时,SO2的转化率:α1<80%<α2 | |
| D. | 平衡时,丙中气体平均相对分子质量与甲相同 |
分析 A.依据图表数据计算达到平衡状态消耗二氧化硫的物质的量,反应速率v=$\frac{△c}{△t}$;
B.根据甲中各物质的平衡浓度计算平衡常数,K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
C.由甲、乙可知,氧气的浓度相同,二氧化硫的浓度增大会促进氧气的转化,二氧化硫转化率减小,乙丙可知二氧化硫浓度相同,氧气浓度增大二氧化硫转化率增大;
D.体积相同,丙中的起始浓度为甲的2倍,压强增大,平衡正向移动,则丙中转化率增大.
解答 解:A.0~5min内,
2SO2(g)+O2(g)?2SO3(g),
开始(mol)0.4 0.24 0
转化(mol)0.32 0.16 0.32
平衡(mol)0.08 0.08 0.32
平衡浓度(mol/L)0.04 0.04 0.16
甲中SO2的反应速率=$\frac{\frac{0.32mol}{2L}}{5min}$=0.032mol•L-1•min-1,故A正确;
B.根据 2SO2(g)+O2(g)?2SO3(g),
开始(mol)0.4 0.24 0
转化(mol)0.32 0.16 0.32
平衡(mol)0.08 0.08 0.32
平衡浓度(mol/L)0.04 0.04 0.16
所以该温度下,平衡常数值K=$\frac{0.1{6}^{2}}{0.0{4}^{2}×0.04}$=400,故B正确;
C.由甲、乙可知,氧气的浓度相同,二氧化硫的浓度增大会促进氧气的转化,二氧化硫转化率减小,乙丙可知二氧化硫浓度相同,氧气浓度增大二氧化硫转化率增大,则平衡时,SO2的转化率:α1<80%<α2 ,故C正确;
D.体积相同,丙中的起始浓度为甲的2倍,但由于该反应是气体体积改变的反应,体积不变增加浓度,压强增大,平衡正向移动,则丙中转化率增大,气体质量不变,气体物质的量不同,平衡时,丙中气体平均相对分子质量与甲不相同,故D错误;
故选D.
点评 本题考查化学平衡的计算,熟悉化学平衡的三段法计算及影响平衡移动的因素即可解答,注意平衡常数只与温度有关,计算平衡常数应利用平衡浓度,题目难度中等.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案| A. | CO2 | B. | NaCl | C. | HCl | D. | CH4 |
| A. | 大量使用化肥和农药,能不断提高农作物产量 | |
| B. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| C. | 通过有机合成,可以制造出比钢铁更强韧的新型材料 | |
| D. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 |
| A. | 明矾可用于净水 | |
| B. | 氨可用于生产铵盐、纯碱 | |
| C. | 铝热反应可用于冶炼某些金属 | |
| D. | 核磁共振氢谱可用于测量某些有机物的相对分子质量 |
| 化学键 | H-Cl | Cl-Cl | H-H | C-H | C-Cl |
| 键能/(kJ•mol-1) | 431.4 | 242.1 | 435.9 | 413.0 | 338.9 |
(2)判断甲烷的氯代反应Cl2(g)+CH4(g)═CH3Cl(g)+HCl(g),是吸热反应还是放热反应?
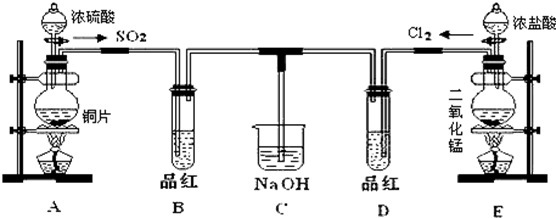

 中,在同一平面上的碳原子最少有9个,最多有14个.
中,在同一平面上的碳原子最少有9个,最多有14个.