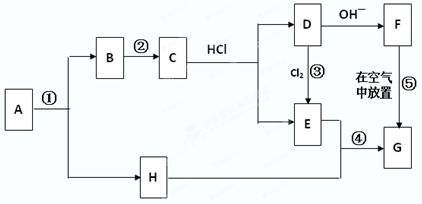
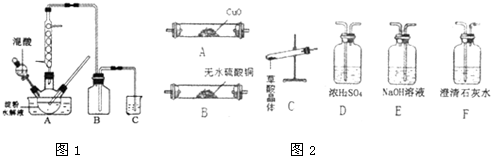
题目内容
 硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,①若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡
②若温度T1、T2时反应的平衡常数分别为K1,K2,则K1
考点:化学平衡的影响因素
专题:
分析:①恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,压强降低平衡向体积增大方向移动;
②由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,升高温度向吸热反应方向移动;
D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行.
②由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,升高温度向吸热反应方向移动;
D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行.
解答:
解:①恒温、恒压条件下向上述平衡体系中通入氦气,体积应增大,反应混合物各组分的浓度降低,等效为降低压强,压强降低平衡向体积增大方向移动,即向左移动,故答案为:向左;
②由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,即向左移动,升高温度向吸热反应方向移动,即该反应正反应为放热反应,温度升高,平衡向吸热方向移动,即向逆反应移动,K值减小,K1>K2,D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行,所以V正>V逆,故答案为:>;>.
②由图可知,温度越高,混合体系中SO3的百分含量越小,说明升高温度平衡向逆反应进行,即向左移动,升高温度向吸热反应方向移动,即该反应正反应为放热反应,温度升高,平衡向吸热方向移动,即向逆反应移动,K值减小,K1>K2,D状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行,所以V正>V逆,故答案为:>;>.
点评:本题考查化学平衡的影响因素,学生只要会识别图象中的关键点和曲线的走向,就能迅速解题.

练习册系列答案
相关题目
在运输酒精的纸箱外应当粘贴的标志是( )
A、 |
B、 |
C、 |
D、 |
下列方程式中,属于电离方程式并且书写正确的是( )
| A、HCO3-+H2O?H2CO3+OH- |
| B、NH3?H2O?NH4++OH- |
| C、NH3+H+=NH4+ |
| D、HCO3-+OH-=H2O+CO32- |
用NA表示阿伏伽德罗常数,下列叙述不正确的是( )
| A、标准情况下,22.4LH2含有的分子数为1NA |
| B、常温常压下,1.06gNa2CO3(相对分子质量为106)含有的Na+离子数为0.02NA |
| C、常温常压下,6.02×1023个CO2分子占有的体积为22.4L |
| D、1L物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
酸、碱、盐在工农业生产和日常生活中具有广泛应用.下列关于酸、碱、盐的生产和应用说法不正确的是( )
| A、将氯化铵与草木灰混合施用 |
| B、纯碱既可以从内陆盐湖中提取,又可以用“侯氏制碱法”生产 |
| C、用石灰乳与硫酸铜溶液配制波尔多液 |
| D、高温煅烧石灰石可制生石灰 |
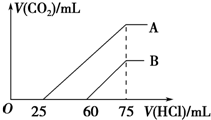 向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.
向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.