题目内容
常温下,pH=3的一元酸和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应.下列说法不正确的是( )
| A、两溶液混合反应后的所得的混合溶液呈碱性 |
| B、所用酸溶液的浓度大于所用氢氧化钠溶液的浓度 |
| C、若酸为醋酸,原醋酸溶液中有1%的醋酸已电离 |
| D、若酸为醋酸,反应后的溶液中CH3OO-与CH3COOH的平衡浓度之和约为0.05mol?L-1 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:pH=3的一元酸中C(H+)=10-3mol/L,pH=13的氢氧化钠溶液是强电解质溶液,其中C(OH-)=0.1mol/L,即C(NaOH)=0.1mol/L;等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,可知,两者的浓度相同,即酸和氢氧化钠溶液的浓度均为0.1mol/L,且酸为一元弱酸,据此分析.
解答:
解:A、由于酸为一元弱酸,两者恰好完全反应后得强碱弱酸盐,水解显碱性,故A正确;
B、等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,据n=CV可知,可知,两者的浓度相同,故B错误;
C、若为醋酸,由于酸的浓度为0.1mol/L,而C(H+)=10-3mol/L,故电离程度=
×100%=1%,故C正确;
D、若酸为醋酸,则所得醋酸钠溶液的浓度为0.05mol/L,CH3COO-是弱酸根,会部分水解为CH3COOH,根据物料守恒可知,CH3OO-与CH3COOH的平衡浓度之和约为0.05mol?L-1,故D正确.
故选B.
B、等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应,据n=CV可知,可知,两者的浓度相同,故B错误;
C、若为醋酸,由于酸的浓度为0.1mol/L,而C(H+)=10-3mol/L,故电离程度=
| 0.001 |
| 0.1 |
D、若酸为醋酸,则所得醋酸钠溶液的浓度为0.05mol/L,CH3COO-是弱酸根,会部分水解为CH3COOH,根据物料守恒可知,CH3OO-与CH3COOH的平衡浓度之和约为0.05mol?L-1,故D正确.
故选B.
点评:本题考查了酸碱混合后的反应情况的判断和所得盐溶液中离子浓度的守恒关系,难度适中,应注意的是相同物质的量的一元弱酸和一元强酸,所消耗的氢氧化钠的物质的量是相同的.

练习册系列答案
相关题目
25℃时,将a mol?L-1氨水与0.1mol?L-1的HCl等体积混合,下列有关说法正确的是( )
| A、若氨水中c(OH-)=0.1mol?L-1则混合溶液中c(H+)=c(OH-) | ||
| B、若a=0.1则混合溶液中c(H+)=c(Cl-) | ||
| C、若c(NH4+)+c(H+)=c(Cl-)+c(OH-)则一定有a=0.1 | ||
D、若混合后溶液中c(H+)=c(OH-)=10-7mol?L-1则常温下氨水的电离常数为
|
工业上常用焦炭和二氧化硅在电炉中发生氧化还原反应制取粗硅,反应方程式为:2C+SiO2
Si+2CO↑.下列叙述不正确的是( )
| ||
| A、C是还原剂,发生还原反应 |
| B、SiO2是氧化剂,在反应中被还原 |
| C、氧化还原反应的实质是电子的转移 |
| D、氧化还原反应中电子转移的总数与化合价升降总数相等 |
NA为阿伏加德罗常数,下列说法正确的是( )
| A、1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA |
| B、标准状况下,22.4 L NH3中含有电子数为8NA |
| C、1 molCl2与足量Fe反应转移电子数一定为3NA |
| D、1mo1?L-1的AlC13溶液中,C1-的数目为3 NA |
将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+ 分别加入H2O中,基本上不影响水的电离平衡的是( )
| A、①③⑤⑦⑧ | B、②④⑦ |
| C、①⑥ | D、②④⑥⑧ |
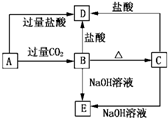 A,B,C,D,E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,且焰色反应呈浅紫色(透过蓝色钴玻璃).B为难溶的白色固体,A和E的阴离子相同.请回答下了问题:
A,B,C,D,E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,且焰色反应呈浅紫色(透过蓝色钴玻璃).B为难溶的白色固体,A和E的阴离子相同.请回答下了问题: