题目内容
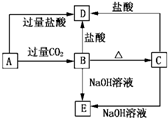 A,B,C,D,E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,且焰色反应呈浅紫色(透过蓝色钴玻璃).B为难溶的白色固体,A和E的阴离子相同.请回答下了问题:
A,B,C,D,E五种化合物,均含有某种常见元素,它们的转化关系如图所示,其中A为澄清溶液,且焰色反应呈浅紫色(透过蓝色钴玻璃).B为难溶的白色固体,A和E的阴离子相同.请回答下了问题:(1)写出下列物质的化学式:A
(2)写出下列反应的离子方程式:
A→B:
B→D:
C→E:
考点:无机物的推断
专题:推断题
分析:B、C都既能与盐酸反应又能与NaOH溶液反应,应为两性化合物,因B加热分解可生成C,则可知B为Al(OH)3,C为A12O3,则D为AlCl3,E为NaAlO2,若取A溶液焰色反应为紫色(透过蓝色钴玻璃片),说明A中含有K元素,A能与二氧化碳反应生成Al(OH)3,A和E的阴离子相同,则A应为KAlO2,结合对应物质的性质解答该题.
解答:
解:B、C都既能与盐酸反应又能与NaOH溶液反应,应为两性化合物,因B加热分解可生成C,则可知B为Al(OH)3,C为A12O3,则D为AlCl3,E为NaAlO2,若取A溶液焰色反应为紫色(透过蓝色钴玻璃片),说明A中含有K元素,A能与二氧化碳反应生成Al(OH)3,A和E的阴离子相同,则A应为KAlO2,
(1)通过以上分析知,A、B、C、D、E分别是KAlO2、Al(OH)3、A12O3、AlCl3,故答案为:KAlO2;Al(OH)3;A12O3;AlCl3;
(2)A→B的反应为AlO2-和Al(OH)3的转化,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
B→D的反应为Al(OH)3和Al3+的转化,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,
C→E为A12O3和NaAlO2的转化,反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;Al(OH)3+3H+=Al3++3H2O;Al2O3+2OH-═2AlO2-+H2O.
(1)通过以上分析知,A、B、C、D、E分别是KAlO2、Al(OH)3、A12O3、AlCl3,故答案为:KAlO2;Al(OH)3;A12O3;AlCl3;
(2)A→B的反应为AlO2-和Al(OH)3的转化,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
B→D的反应为Al(OH)3和Al3+的转化,反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,
C→E为A12O3和NaAlO2的转化,反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;Al(OH)3+3H+=Al3++3H2O;Al2O3+2OH-═2AlO2-+H2O.
点评:本题考查无机物的推断,侧重铝及其化合物之间的转化,为高频考点,注意根据B能和强酸、强碱反应且加热易分解推断知,B是氢氧化铝,再结合物质的反应条件、反应物来分析解答,难度中等.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
常温下,pH=3的一元酸和pH=13的氢氧化钠溶液等体积混合后(不考虑混合后溶液体积的变化),恰好完全反应.下列说法不正确的是( )
| A、两溶液混合反应后的所得的混合溶液呈碱性 |
| B、所用酸溶液的浓度大于所用氢氧化钠溶液的浓度 |
| C、若酸为醋酸,原醋酸溶液中有1%的醋酸已电离 |
| D、若酸为醋酸,反应后的溶液中CH3OO-与CH3COOH的平衡浓度之和约为0.05mol?L-1 |

 某芳香化合物H常用作食用香精.用质谱法测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1.H只有一个支链;它能与溴的四氯化碳溶液发生加成反应.且在碱性条件下能发生水解反应,产物之一是甲醇.G是H的同分异构体.用芳香烃A为原料合成G的路线如图.
某芳香化合物H常用作食用香精.用质谱法测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1.H只有一个支链;它能与溴的四氯化碳溶液发生加成反应.且在碱性条件下能发生水解反应,产物之一是甲醇.G是H的同分异构体.用芳香烃A为原料合成G的路线如图.