题目内容
14.为了探究外界条件对反应速率的影响,某化学小组利用KI溶液在酸性条件下能被空气中的O2氧化来实现该目的.该反应的离子方程式为O2+4I-+4H+=212+2H2O(1)该小组同学设计如下实验,完成下表中①和②的内容.(限选试剂:0.l mol/L硫酸、0.2mol/L硫酸、I mol/L KOH溶液、淀粉溶液).
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 淀粉溶液 | 实验目的 | ||
| C(KI) | V | C(H2SO4) | V | ||||
| 1 | 25℃ | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | l组和2组探究②温度对该反应速率的影响;2组和3组探究反应物浓度对该反应速率的影响 |
| 2 | 35℃ | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | |
| 3 | 35℃ | 1mol/L | 5mL | ①0.2mol/L硫酸 | 5mL | 3滴 | |
A.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
B.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
C.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
(3)实验中,发现露置在空气中的KI溶液逐渐变黄色.通过查阅资料知:KI溶液在空气中会生成I2和KOH.小组同学对该描述有疑问:I2为何能与KOH共存?为此提出下列假设进行探究:
假设一:常温下,I2和KOH不反应;假设二:溶液碱性弱,I2和KOH不反应; 假设三:…
请设计实验验证假设二,完成表中的内容
| 实验方案 | 预期实验现象与结论 |
| 取少量碘水于试管中,滴入几滴淀粉溶液,然后逐滴加入1mol/L KOH溶液,观察现象. | 若蓝色不褪色,则假设二正确. |
分析 KI中-1价的碘离子具有还原性,氧气具有氧化性,两者发生氧化还原反应,生成碘单质和水,结合原子守恒和电荷守恒书写离子方程式.
(1)根据表格,对比①②的数据,可以看出实验①②是探究温度对反应速率的影响;实验①③是探究反应物浓度对该反应速率的影响,所以此时两个实验中H2SO4溶液应当不相等,据此答题;
(2)实验中应先向一定体积的KI溶液中滴加淀粉溶液,然后再加入稀硫酸,在酸性条件下发生氧化还原反应生成碘,应记录的数据为反应的时间;
(3)淀粉与碘水作用显蓝色,加入氢氧化钾,若蓝色不褪色,说明溶液中溶液碱性弱,I2和KOH不反应.
解答 解:KI中-1价的碘离子具有还原性,氧气具有氧化性,两者发生氧化还原反应,反应的离子方程式为:O2+4I-+4H+=212+2H2O,
故答案为:O2+4I-+4H+=212+2H2O.
(1)根据表格,对比①②的数据,可以看出温度不一样,其它条件都一样,所以实验①②是探究温度对反应速率的影响;实验①③是探究反应物浓度对该反应速率的影响,所以此时两个实验中H2SO4溶液应当不相等,所以选择0.2mol/L硫酸,
故答案为:0.2mol/L硫酸;温度;
(2)探究不同条件对O2+4I-+4H+=212+2H2O反应速率的影响,淀粉遇碘变蓝色,实验中应先向一定体积的KI溶液中滴加淀粉溶液,然后再加入稀硫酸,在酸性条件下发生氧化还原反应生成碘,可根据颜色的变化判断反应速率,应记录的内容是溶液从无色变为蓝色所需的时间,
故答案为:C;溶液从无色变为蓝色所需的时间;
(3)淀粉与碘水作用显蓝色,加入氢氧化钾,若蓝色不褪色,说明溶液中溶液I2和KOH不反应,即验证假设2碱性弱,I2和KOH不反应,
故答案为:碘水;1mol/L KOH溶液;蓝色不褪色.
点评 本题主要考查浓度、温度对反应速率的影响,注意掌握温度、浓度、压强等对反应速率的影响,旨在考查学生灵活运用基础知识解决实际问题的能力,题目难度中等.

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案| A. | 28gC2H4和CO的混合气体中含有的分子数为NA | |
| B. | 28gN2和6gH2充分反应,生成NH3的分子数为2NA | |
| C. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| D. | 0.1molFeCl3完全水解转化为氢氧化铁胶体,生成0.1NA个胶粒 |
| A. | 蒸发操作时,当有大量晶体析出时停止加热,用余热使水蒸发 | |
| B. | 蒸馏操作中冷凝管的冷却水应下进上出 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 浓硫酸的稀释可以在量筒中进行 |
| A. | 10ml质量分数为98%的H2SO4,用10ml水稀释后,H2SO4的质量分数大于49% | |
| B. | 配制0.1mol/L的Na2CO3溶液480mL,需用500mL容量瓶 | |
| C. | 制备Fe(OH)3胶体时,将饱和FeCl3溶液滴入沸水中,边加热边搅拌,直到得到红褐色溶液 | |
| D. | 向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2、和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变) |
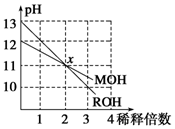 MOH和ROH两种一元碱的溶液分别加水稀释10n倍时,pH变化与n的关系如图所示.下列叙述中正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释10n倍时,pH变化与n的关系如图所示.下列叙述中正确的是( )| A. | MOH和ROH都是强碱 | |
| B. | 稀释前,ROH=10MOH | |
| C. | 常温下pH之和为14的醋酸和ROH溶液等体积混合,所得溶液呈碱性 | |
| D. | 在x点,M+=R+ |
| A. | Mg(OH)2的溶解度最小 | |
| B. | Ca(OH)2的溶解度最小 | |
| C. | AgCl的溶解度最小 | |
| D. | 同一温度下Ksp越大的溶解度也越大 |
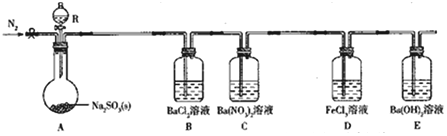
实验现象:B中无沉淀生成,C中有白色沉淀;D中溶液颜色变浅,E中产生白色沉淀.
(1)仪器R的名称是分液漏斗.
(2)实验室在常温下用80%的硫酸与亚硫酸钠粉末反应制备SO2,写出A中反应的化学方程式:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O.
(3)部分实验步骤如下:连接装置、检查气密性、装药品,向装置中通入一段时间N2,然后启动A中反应.“通入一段时间的N2”的目的是排尽装置内空气,避免O2干扰实验.
(4)探究装置C中通入SO2的量与产物的关系.
①他们提出如下猜想:
猜想1:通入过量的SO2,则发生反应的离子方程式为Ba2++2NO3-+3SO2+2H2O═BaSO4↓+2SO42-+2NO+4H+.
猜想2:通入少量的SO2,则发生反应的离子方程式为3Ba2++2NO3-+3SO2+2H2O=BaSO4↓+2NO+4H+.
②请你帮他们设计实验证明猜想1和猜想2哪个合理,完成下列实验:
提供试剂:溴水、铜粉、Ba(NO3)2溶液、BaCl2溶液、Na2CO3溶液
| 实验步骤 | 实验现象及结论 |
| 取少量C中反应后溶液于试管中,加入铜粉(或BaCl2溶液) | 若铜粉溶解,溶液变蓝色(或无沉淀),则猜想2正确;若铜粉不溶解(或产生白色沉淀),则猜想1正确 |
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.KSCN溶液和双氧水
(6)常温下,实验完毕后,分离、提纯装置E中白色固体M,取适置M于试管中,滴少量盐酸(M剩余),所得溶液的pH<7(填“>”“<”或“=”).