题目内容
2013年6月“蛟龙”号载人潜水器投入应用中,计划每年将有4至5个月的海上时间,可用于深海探矿.锰结核中的黄铜矿(CuFeS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一,还可用于制备硫及铁的化合物.请回答下列问题:
(1)“蛟龙”号外壳用特殊的钛合金材料制成,它可以在深海中承受700个大气压的压力.下列说法正确的是 .
A.已知金属钛的原子序数为22,则其属于主族元素
B.钛合金强度很大
C.制备钛铝合金时可在空气中将两种金属混合后熔化而成
D.可用电解熔融二氧化钛的方法冶炼金属钛
(2)利用黄铜矿冶炼铜的反应为:8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号),生成1mol Fe2O3转移电子的物质的量为 mol
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法如下:
a.用过量稀盐酸浸取炉渣,过滤.
b.滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
①a中过滤的目的是 .
②除去Al3+的化学方程式是 .
③b中将滤液氧化常选用H2O2,其反应的离子方程式为 .
④选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水所选试剂为 . 证明炉渣中含有FeO的实验现象为 .
(4)将Cu放入0.1mol?L-1 FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为 .
(1)“蛟龙”号外壳用特殊的钛合金材料制成,它可以在深海中承受700个大气压的压力.下列说法正确的是
A.已知金属钛的原子序数为22,则其属于主族元素
B.钛合金强度很大
C.制备钛铝合金时可在空气中将两种金属混合后熔化而成
D.可用电解熔融二氧化钛的方法冶炼金属钛
(2)利用黄铜矿冶炼铜的反应为:8CuFeS2+21O2
| ||
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法如下:
a.用过量稀盐酸浸取炉渣,过滤.
b.滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
①a中过滤的目的是
②除去Al3+的化学方程式是
③b中将滤液氧化常选用H2O2,其反应的离子方程式为
④选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水所选试剂为
(4)将Cu放入0.1mol?L-1 FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为
考点:物质分离和提纯的方法和基本操作综合应用,氧化还原反应,氧化还原反应的计算,铜金属及其重要化合物的主要性质
专题:氧化还原反应专题,元素及其化合物
分析:(1)A.金属钛的原子序数为22,位于第四周期第IIB族;
B.钛合金强度很大,可以在深海中承受700个大气压的压力;
C.在空气中加热金属易被氧化;
D.钛性质较活泼,可以采用电解熔融二氧化钛的方法冶炼金属钛;
(2)8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2中部分Fe元素化合价由+2价变为+3价、O元素化合价由0价变为-2价、Cu元素化合价由+2价变为0价、S元素化合价由-2价变为+4价,得电子化合价降低的元素被还原,根据氧化铁和转移电子之间的关系式计算;
(3)用过量稀盐酸浸取炉渣,发生的反应有Fe2O3+6HCl=2FeCl3+3H2O、FeO+2HCl=FeCl2+H2O、Al2O3+6HCl=2AlCl3+3H2O,过滤后的滤渣是SiO2,
滤液先氧化,将亚铁离子氧化为铁离子,然后再加入过量NaOH溶液,发生反应Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,过滤,将沉淀Fe(OH)3洗涤、干燥、煅烧得Fe2O3;
(4)设原FeCl3溶液的体积为1L,参加反应的Fe3+为xmol,由方程式Cu+2Fe3+=2Fe2++Cu2+,知(0.1-x):x=2:3,解得:x=0.06,则生成的Cu2+为0.03mol,剩余的Fe3+为0.04mol,据此计算Cu2+与Fe3+的物质的量之比.
B.钛合金强度很大,可以在深海中承受700个大气压的压力;
C.在空气中加热金属易被氧化;
D.钛性质较活泼,可以采用电解熔融二氧化钛的方法冶炼金属钛;
(2)8CuFeS2+21O2
| ||
(3)用过量稀盐酸浸取炉渣,发生的反应有Fe2O3+6HCl=2FeCl3+3H2O、FeO+2HCl=FeCl2+H2O、Al2O3+6HCl=2AlCl3+3H2O,过滤后的滤渣是SiO2,
滤液先氧化,将亚铁离子氧化为铁离子,然后再加入过量NaOH溶液,发生反应Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,过滤,将沉淀Fe(OH)3洗涤、干燥、煅烧得Fe2O3;
(4)设原FeCl3溶液的体积为1L,参加反应的Fe3+为xmol,由方程式Cu+2Fe3+=2Fe2++Cu2+,知(0.1-x):x=2:3,解得:x=0.06,则生成的Cu2+为0.03mol,剩余的Fe3+为0.04mol,据此计算Cu2+与Fe3+的物质的量之比.
解答:
解:(1)A.金属钛的原子序数为22,位于第四周期第IIB族,属于过渡元素,故A错误;
B.钛合金可以在深海中承受700个大气压的压力,钛合金强度很大,故B正确;
C.在空气中加热熔化,金属易与氧气发生反应,所以不能直接在空气中制备钛铝合金,故C错误;
D.由于金属钛金属性较强,所以可以用电解法冶炼,故D正确;
故选BD;
(2)8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2中部分Fe元素化合价由+2价变为+3价、O元素化合价由0价变为-2价、Cu元素化合价由+2价变为0价、S元素化合价由-2价变为+4价,得电子化合价降低的元素被还原,所以Cu、O元素被还原;
21mol氧气反应时得到84mol电子,而铁元素失去4mol电子,硫元素失去96mol电子,根据得失电子守恒,铜元素应得到16mol电子,所以生成1mol氧化铁时转移50mol电子,
故答案为:Cu、O;50;
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法如下:
用过量稀盐酸浸取炉渣,发生的反应有Fe2O3+6HCl=2FeCl3+3H2O、FeO+2HCl=FeCl2+H2O、Al2O3+6HCl=2AlCl3+3H2O,过滤后的滤渣是SiO2,
滤液先氧化,将亚铁离子氧化为铁离子,然后再加入过量NaOH溶液,发生反应Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,过滤,将沉淀Fe(OH)3洗涤、干燥、煅烧得Fe2O3;
①通过以上分析知,a中过滤为除去SiO2,故答案为:除去SiO2;
②Al3+与过量NaOH反应生成NaAlO2,然后通过过滤除去,反应方程式为AlCl3+4NaOH=3NaCl+NaAlO2+2H2O,故答案为:AlCl3+4NaOH=3NaCl+NaAlO2+2H2O;
③双氧水具有强氧化性,亚铁离子具有还原性,二者发生氧化还原反应生成铁离子和水,离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
④二价铁具有还原性,而酸性高锰酸钾溶液具有氧化性,通过酸性高锰酸钾溶液的颜色变化即可证明FeO的存在,所以所选试剂为稀硫酸、KMnO4溶液,实验现象是稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色,
故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色;
(4)设原FeCl3溶液的体积为1L,参加反应的Fe3+为xmol,由方程式Cu+2Fe3+=2Fe2++Cu2+,知(0.1-x):x=2:3,解得:x=0.06,则生成的Cu2+为0.03mol,剩余的Fe3+为0.04mol,故n(Cu2+):n(Fe3+)=0.03mol:0.04mol=3:4,故答案为:3:4.
B.钛合金可以在深海中承受700个大气压的压力,钛合金强度很大,故B正确;
C.在空气中加热熔化,金属易与氧气发生反应,所以不能直接在空气中制备钛铝合金,故C错误;
D.由于金属钛金属性较强,所以可以用电解法冶炼,故D正确;
故选BD;
(2)8CuFeS2+21O2
| ||
21mol氧气反应时得到84mol电子,而铁元素失去4mol电子,硫元素失去96mol电子,根据得失电子守恒,铜元素应得到16mol电子,所以生成1mol氧化铁时转移50mol电子,
故答案为:Cu、O;50;
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法如下:
用过量稀盐酸浸取炉渣,发生的反应有Fe2O3+6HCl=2FeCl3+3H2O、FeO+2HCl=FeCl2+H2O、Al2O3+6HCl=2AlCl3+3H2O,过滤后的滤渣是SiO2,
滤液先氧化,将亚铁离子氧化为铁离子,然后再加入过量NaOH溶液,发生反应Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,过滤,将沉淀Fe(OH)3洗涤、干燥、煅烧得Fe2O3;
①通过以上分析知,a中过滤为除去SiO2,故答案为:除去SiO2;
②Al3+与过量NaOH反应生成NaAlO2,然后通过过滤除去,反应方程式为AlCl3+4NaOH=3NaCl+NaAlO2+2H2O,故答案为:AlCl3+4NaOH=3NaCl+NaAlO2+2H2O;
③双氧水具有强氧化性,亚铁离子具有还原性,二者发生氧化还原反应生成铁离子和水,离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
④二价铁具有还原性,而酸性高锰酸钾溶液具有氧化性,通过酸性高锰酸钾溶液的颜色变化即可证明FeO的存在,所以所选试剂为稀硫酸、KMnO4溶液,实验现象是稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色,
故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色;
(4)设原FeCl3溶液的体积为1L,参加反应的Fe3+为xmol,由方程式Cu+2Fe3+=2Fe2++Cu2+,知(0.1-x):x=2:3,解得:x=0.06,则生成的Cu2+为0.03mol,剩余的Fe3+为0.04mol,故n(Cu2+):n(Fe3+)=0.03mol:0.04mol=3:4,故答案为:3:4.
点评:本题考查元素及其化合物、化学实验、化学计算等知识,意在考查考生在理解所学各部分化学知识的本质区别与内在联系的基础上,运用所掌握的知识进行必要的分析、类推或计算,解释、论证一些具体化学问题的能力.

练习册系列答案
相关题目
下列物质的用途利用其物理性质的是( )
| A、草酸用作还原剂 |
| B、生石灰用作干燥剂 |
| C、苯用作萃取剂 |
| D、铁粉用作抗氧化剂 |
废弃物资源化对于建设资源节约型社会具有重要的意义.铝灰是铝加工行业的废渣,其主要成分为Al、Al2O3,可能还含有KCl、FeO、Fe2O3、MgO、SiO2、MnO2中的若干种.为了确认其成分,某同学依次进行了以下实验:
①将过量的稀盐酸加入铝灰中,充分反应后过滤得到溶液甲和固体乙
②取少量溶液甲滴加AgNO3溶液,生成白色沉淀
③取少量溶液甲分成两等份,向其中一份滴加K3[Fe(CN)6]溶液,产生蓝色沉淀;向另一份滴加KSCN溶液,溶液变成血红色
④取少量溶液甲加入过量NaOH溶液,并置于空气中.充分反应后经过滤、洗涤、灼烧得到1.60g固体丙,将固体丙置于氢气流中加热充分反应后得到1.12g固体丁
根据以上实验现象或数据,该同学得出的结论正确的是( )
①将过量的稀盐酸加入铝灰中,充分反应后过滤得到溶液甲和固体乙
②取少量溶液甲滴加AgNO3溶液,生成白色沉淀
③取少量溶液甲分成两等份,向其中一份滴加K3[Fe(CN)6]溶液,产生蓝色沉淀;向另一份滴加KSCN溶液,溶液变成血红色
④取少量溶液甲加入过量NaOH溶液,并置于空气中.充分反应后经过滤、洗涤、灼烧得到1.60g固体丙,将固体丙置于氢气流中加热充分反应后得到1.12g固体丁
根据以上实验现象或数据,该同学得出的结论正确的是( )
| A、根据①可推出铝灰中一定含有SiO2 |
| B、根据②可推出铝灰中一定含有KCl |
| C、根据③可推出铝灰中一定含有FeO和Fe2O3 |
| D、根据④可推出固体丙中一定不含MgO |
下列有关说法正确的是( )
| A、2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类相同 |
| B、乙烷、苯、葡萄糖溶液均不能使酸性高锰酸钾溶液褪色 |
| C、苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环己烷的密度都比水大 |
| D、乙酸乙酯在碱性条件下的水解反应称为皂化反应 |
化合物A(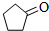 )可由环戊烷经三步反应合成:
)可由环戊烷经三步反应合成: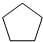
X
Y
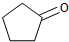
则下列说法错误的是( )
 )可由环戊烷经三步反应合成:
)可由环戊烷经三步反应合成:
| 反应1 |
| 反应2 |
| 反应3 |

则下列说法错误的是( )
| A、反应1可用试剂是氯气 |
| B、反应3可用的试剂是氧气和铜 |
| C、反应1为取代反应,反应2为消去反应 |
| D、A可通过加成反应合成Y |
我国钓鱼岛海域资源丰富,利用海水可制得多种化工产品,其主要工艺流程如图所示:下列分析不正确的是( )


| A、反应①~⑥中属于氧化还原反应的由①⑤⑥ |
| B、粗盐中常常含有Fe2+,工业上可用A物质将其氧化后可加入沉淀剂而除去 |
| C、B、C两种物质可在一定条件下实现相互转化,且可利用BaCl2溶液判断C中是否含有B |
| D、金属Mg在一定条件下能与B的某种分解产物发生置换反应 |
将足量的AgCl(s)分别添加到下述四种溶液中,所得溶液c(Ag+)最小的是( )
| A、10 mL 0.4mol/L的盐酸 |
| B、10 mL 0.3mol/L MgCl2溶液 |
| C、10 mL 0.5mol/LNaCl溶液 |
| D、10 mL 0.1mol/L AlCl3溶液 |
 甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用.某型甲醇燃料电池的总反应式为2CH4O+3O2=2CO2+4H2O,如图是该燃料电池的示意图.下列说法错误的是( )
甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用.某型甲醇燃料电池的总反应式为2CH4O+3O2=2CO2+4H2O,如图是该燃料电池的示意图.下列说法错误的是( )| A、a是甲醇,b是氧气 |
| B、燃料电池将化学能转化为电能 |
| C、质子从M电极区穿过交换膜移向N电极区 |
| D、负极反应:CH4O-6e-+H2O=CO2↑+6H+ |