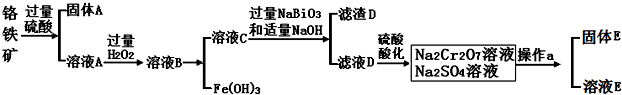
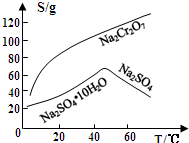
题目内容
7.下列叙述正确的是( )| A. | 含有6.02×1023个氦原子的氦气在标准状况下的体积约为11.2 L | |
| B. | 在常温常压下,11.2 L Cl2含有的分子数为0.5×6.02×1023 | |
| C. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3×6.02×1023 | |
| D. | 标准状况下,11.2 L H2O含有的分子数为0.5×6.02×1023 |
分析 A.稀有气体为单原子分子,含有6.02×1023个氦原子的氦气的物质的量为1mol;
B.常温常压下,不能使用标准状况下的气体摩尔体积计算;
C.根据n=$\frac{m}{M}$计算出二氧化硫的物质的量,再计算出含有的原子数;
D.标准状况下,水的状态不是气体.
解答 解:A.含有6.02×1023个氦原子的氦气的物质的量为1mol,标准状况下1mol气体的体积约为22.4L,故A错误;
B.不是标准状况下,不能使用标准状况下的气体摩尔体积计算11.2LCl2的物质的量,故B错误;
C.64 g SO2的物质的量为:$\frac{64g}{64g/mol}$=1mol,1mol二氧化硫中含有3mol原子,含有的原子数为3×6.02×1023,故C正确;
D.标准状况下水不是气体,不能使用标准状况下的气体摩尔体积计算水的物质的量,故D错误;
故选C.
点评 本题看了阿伏伽德罗常数的计算与判断,题目难度中等,明确标准状况下气体摩尔体积的使用条件为解答关键,注意熟练掌握物质的量与摩尔质量、阿伏伽德罗常数、气体摩尔体积等之间的关系,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
17.下列说法正确的是( )
| A. | 等质量的CH4、C2H4、C2H2分别在氧气中完全燃烧,消耗氧气的量依次减少 | |
| B. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| C. | 苯的结构比较稳定,发生取代反应相对比较容易,发生苯环结构被破坏的加成反应困难得多,而氧化反应不能发生 | |
| D. | 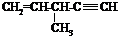 催化加氢可生成3-甲基己烷 催化加氢可生成3-甲基己烷 |
18.同温同压下,将1L SO2和1L Cl2充分混合后通入加有品红的BaCl2溶液中,可观察到的现象为( )
| A. | 溶液褪色 | B. | 产生白色沉淀 | C. | 无明显现象 | D. | 产生黄色沉淀 |
15.已知在0.1mol•L-1的CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+,下列叙述正确的是( )
| 选项 | 改变条件 | 平衡移动方向 | 导电能力 |
| A | 加入蒸馏水 | 逆向移动 | 减弱 |
| B | 加入少量冰醋酸 | 正向移动 | 增强 |
| C | 加入少量CH3COONa固体 | 正向移动 | 增强 |
| D | 加入少量0.1mol•L-1的稀硫酸 | 逆向移动 | 减弱 |
| A. | A | B. | B | C. | C | D. | D |
2.下列说法正确的是( )
| A. | 某溶液与Na0H溶液共热.产生使湿润的石蕊试纸变红的气体,说明原溶液中存在NH${\;}_{4}^{+}$ | |
| B. | 某溶液中加人AgN03溶液时,产生白色沉淀.说明原溶液中含有Cl- | |
| C. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧时,火焰呈黄色,说明原溶液中含有金属钠 | |
| D. | 某溶液中加人BaCl2溶液时,产生白色沉淀.原溶液中可能存在Ag+或SO42-或CO32- |
8.在密闭的容器中进行如下反应:X(g)+2Y(g)?3Z(g),根据图象对应的叙述一定正确的是( )

| A. | a与b比较,b使用了催化剂 | B. | a与b比较,b温度更高 | ||
| C. | a与b比较,b的压强更大 | D. | a与b比较,b反应速率更大 |
5.下列说法中正确的是( )
| A. | 某溶液与NaOH溶液共热.产生能使湿润的红色石蕊试纸变蓝的气体,说明原溶液中存在NH4+ | |
| B. | 某溶液中加入盐酸后有无色气体产生,该气体能够使澄清的石灰水变浑浊,则原溶液中含CO32- | |
| C. | 用铂丝蘸取某溶液在酒精灯的火焰上灼烧时.火焰呈黄色,说明原溶液中只含有Na+,不含有K+ | |
| D. | 某溶液中加入BaCl2溶液时,产生白色沉淀,加稀硝酸沉淀不溶解,说明原溶液中存在SO42- |
6.对表中方程式的评价正确的是( )
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与硝酸反应:Fe3O4+8H+ ═Fe2++2Fe3++4H2O | 书写正确 |
| B | 工业制粗硅:SiO2+C$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | 错误,生成物应是Si和CO |
| C | NaAlO2溶液与少量CO2反应: AlO2- ̄+CO2+2H2O═HCO3- ̄+Al(OH)3↓ | 书写正确 |
| D | NaHCO3溶液中加入少量石灰水:Ca2++2OH-+2HCO-3=CaCO3↓+CO32-+2H2O | 错误,生成物 中不含CO32- |
| A. | A | B. | B | C. | C | D. | D |