题目内容
 氮是大气中含量丰富的一种元素,请回答下列氦及其化合物的相关问题:
氮是大气中含量丰富的一种元素,请回答下列氦及其化合物的相关问题:(1)N4结构与白鳞分子的结构相似.已知断裂1molN-N键吸收167kj热量,生成1molN=N键放出942kj热量,请写出通常条件下N4气体完全转变为N2反应的热化学方程式:
(2)NH3可直接用作车用燃料电池产物无污染,写出碱性介质下该电池的负极反应式:
(3)对于平衡:2NO2(g)?N2O4(g),在相同条件下,分别将2molNO2置于恒压容器Ⅰ和恒容容器Ⅱ中,起始时两容器体积相同,保持温度不变充分反应.
①该反应的平衡常数表达式为
②达到平衡后,两容器中N2O4的体积分数关系是Ⅰ
③t1时刻分别向两容器的平衡体系中再加入2mol NO2,t2时刻再次达到平衡.
下列说法正确的是
A.t1时刻两容器中平衡均向右移动
B.t2时刻若再向两容器中加入稀有气体,两容器中平衡均向右移动
C.t2时刻再次达到平衡时,两容器中N2O4的体积分数关系是Ⅰ<Ⅱ
D.t2时刻再次达到平衡时,两容器中NO2的浓度关系是Ⅰ>Ⅱ
考点:化学平衡的计算,热化学方程式,原电池和电解池的工作原理
专题:
分析:(1)N4气体转变为N2气体先破坏N4分子N-N键吸收能量,再生成N2分子形成N≡N键放出能量,注意一个N4分子中含有6个N-N键,根据能量的变化写出热化学反应方程式;
(2)原电池中,负极上失去电子发生氧化反应,注意结合电解质溶液的酸碱性写电极反应式;
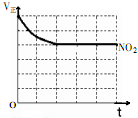
(3)①根据化学平衡常数的定义书写;N2O4的V正随时间变化逐渐减小;
②反应起始时,NO2的浓度相同、温度相同、压强相同,反应速率相同,容器Ⅱ中压强降低,容器Ⅰ体积可变,压强不变,故反应达到平衡时,两容器内的压强关系是p(Ⅰ)>p(Ⅱ);
③t1时刻分别向两容器的平衡体系中再加入2mol NO2,t2时刻再次达到平衡时,由于Ⅰ是恒温恒压,平衡为等效平衡;Ⅱ是恒温恒容,平衡右移.
(2)原电池中,负极上失去电子发生氧化反应,注意结合电解质溶液的酸碱性写电极反应式;
(3)①根据化学平衡常数的定义书写;N2O4的V正随时间变化逐渐减小;
②反应起始时,NO2的浓度相同、温度相同、压强相同,反应速率相同,容器Ⅱ中压强降低,容器Ⅰ体积可变,压强不变,故反应达到平衡时,两容器内的压强关系是p(Ⅰ)>p(Ⅱ);
③t1时刻分别向两容器的平衡体系中再加入2mol NO2,t2时刻再次达到平衡时,由于Ⅰ是恒温恒压,平衡为等效平衡;Ⅱ是恒温恒容,平衡右移.
解答:
解:(1)根据原子守恒知,一个N4分子生成2个N2分子,一个N4分子中含有6个N-N键,破坏1molN4分子中含有6molN-N键需要吸收167kJ/mol×6mol=1002KJ能量;
生成2molN≡N键放出942kJ/mol×2mol=1884KJ能量,所以该反应放出1884KJ-1002KJ=882KJ能量,所以热化学反应方程式为N4(g)=2N2(g)△H=-882KJ/mol,
故答案为:N4(g)=2N2(g)△H=-882KJ/mol;
(2)原电池中,负极上失去电子发生氧化反应,该反应中氨气发生氧化反应,所以负极上发生的反应是:氨气失电子和氢氧根离子反应生成氮气和水,电极反应式为
2NH3+6OH--6e-=N2+6H2O,故答案为:2NH3+6OH--6e-=N2+6H2O;
(3)①对于平衡:2NO2(g)?N2O4(g),该反应的平衡常数表达式为K=
;N2O4的V正随时间变化逐渐减小,故图象为 ,故答案为:K=
,故答案为:K=
; ;
;
②反应起始时,NO2的浓度相同、温度相同、压强相同,反应速率相同,容器Ⅱ中压强降低,容器Ⅰ体积可变,压强不变,故反应达到平衡时,两容器内的压强关系是p(Ⅰ)>p(Ⅱ),Ⅰ中平衡正向进行,平衡时N2O4体积分数增大,两容器中N2O4的体积分数关系是Ⅰ>Ⅱ,故答案为:>;
③t1时刻分别向两容器的平衡体系中再加入2mol NO2,t2时刻再次达到平衡时,由于Ⅰ是恒温恒压,平衡为等效平衡;Ⅱ是恒温恒容,平衡右移.
A.t1时刻NO2浓度均增加,故平衡均右移,故A正确
B.t2时刻若再向两容器中加入稀有气体,Ⅰ平衡左移,Ⅱ不移动,故B错误;
C.t2时刻再次达到平衡时,Ⅰ为等效平衡,Ⅱ是恒温恒容,平衡右移,所以两容器中N2O4的体积分数关系是Ⅰ<Ⅱ,故C正确;
D.t2时刻再次达到平衡时,Ⅰ为等效平衡,Ⅱ是恒温恒容,平衡右移,两容器中NO2的浓度关系是Ⅰ<Ⅱ,故D错误;
故答案为:AC.
生成2molN≡N键放出942kJ/mol×2mol=1884KJ能量,所以该反应放出1884KJ-1002KJ=882KJ能量,所以热化学反应方程式为N4(g)=2N2(g)△H=-882KJ/mol,
故答案为:N4(g)=2N2(g)△H=-882KJ/mol;
(2)原电池中,负极上失去电子发生氧化反应,该反应中氨气发生氧化反应,所以负极上发生的反应是:氨气失电子和氢氧根离子反应生成氮气和水,电极反应式为
2NH3+6OH--6e-=N2+6H2O,故答案为:2NH3+6OH--6e-=N2+6H2O;
(3)①对于平衡:2NO2(g)?N2O4(g),该反应的平衡常数表达式为K=
| c(N2O4) |
| c2(NO2) |
 ,故答案为:K=
,故答案为:K=| c(N2O4) |
| c2(NO2) |
 ;
;②反应起始时,NO2的浓度相同、温度相同、压强相同,反应速率相同,容器Ⅱ中压强降低,容器Ⅰ体积可变,压强不变,故反应达到平衡时,两容器内的压强关系是p(Ⅰ)>p(Ⅱ),Ⅰ中平衡正向进行,平衡时N2O4体积分数增大,两容器中N2O4的体积分数关系是Ⅰ>Ⅱ,故答案为:>;
③t1时刻分别向两容器的平衡体系中再加入2mol NO2,t2时刻再次达到平衡时,由于Ⅰ是恒温恒压,平衡为等效平衡;Ⅱ是恒温恒容,平衡右移.
A.t1时刻NO2浓度均增加,故平衡均右移,故A正确
B.t2时刻若再向两容器中加入稀有气体,Ⅰ平衡左移,Ⅱ不移动,故B错误;
C.t2时刻再次达到平衡时,Ⅰ为等效平衡,Ⅱ是恒温恒容,平衡右移,所以两容器中N2O4的体积分数关系是Ⅰ<Ⅱ,故C正确;
D.t2时刻再次达到平衡时,Ⅰ为等效平衡,Ⅱ是恒温恒容,平衡右移,两容器中NO2的浓度关系是Ⅰ<Ⅱ,故D错误;
故答案为:AC.
点评:本题考查了反应热、原电池、化学平衡移动、化学平衡常数及计算等,难度中等,考查学生分析和解决问题的能力和对知识的掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
25℃时,已知弱酸的电离常数:K(CH3COOH)=1.8×10-5;K1(H2CO3)=4.4×10-7;K2(H2CO3)=4.7×10-11;K(HClO)=4.0×10-8.则下列说法正确的是( )
| A、25℃时,0.1mol/L的醋酸溶液比0.01mol/L的醋酸溶液的K值小 |
| B、25℃时,甲基橙滴入0.1mol/L的醋酸溶液中,溶液呈黄色 |
| C、新制氯水与碳酸氢钠不反应 |
| D、等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pH:pH(Na2CO3)>pH(NaClO)>pH(CH3COONa) |
对于平衡体系:aA(g)+bB(g)?Cc(g)+Dd(s)△H<0,下列判断中正确的是( )
| A、若a+b<c+d,则反应一定能自发向右进行 |
| B、若从正反应开始,起始时A、B的物质的量之比为a:b,则平衡时A、B的转化率之比也为a:b |
| C、若a+b=c+d,在平衡体系中共有气体m mol,再向其中充入n mol B,则达到平衡时气体总物质的量小于(m+n)mol |
| D、若a+b=c+d,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的压强一定不变 |
淀粉溶液是一种胶体,并且淀粉遇到碘单质可以出现明显的蓝色特征,现将淀粉和稀Na2SO4溶液混合,装在半透膜中,浸泡在盛有蒸馏水的烧杯中,过一段时间后,取烧杯中液体进行实验,能证明半透膜完好无损的是( )
| A、加入Ba(NO3)2溶液产生白色的沉淀. |
| B、加入碘水变蓝 |
| C、加入Ba(NO3)2溶液没有白色沉淀 |
| D、加入碘水不变蓝 |
6.4gCu跟60.0mL 10.0mol/L的HNO3充分反应后全部溶解,还原产物有NO和NO2.若反应后溶液中有a mol H+,则此时溶液中含NO-3离子的物质的量为( )
| A、(0.6-a)mol |
| B、(0.6-a-0.2 )mol |
| C、0.2amol |
| D、(0.2+a)mol |