题目内容
6.4gCu跟60.0mL 10.0mol/L的HNO3充分反应后全部溶解,还原产物有NO和NO2.若反应后溶液中有a mol H+,则此时溶液中含NO-3离子的物质的量为( )
| A、(0.6-a)mol |
| B、(0.6-a-0.2 )mol |
| C、0.2amol |
| D、(0.2+a)mol |
考点:氧化还原反应的计算
专题:
分析:n(Cu)=
=0.1mol,与硝酸反应生成Cu2+,根据溶液的电荷守恒可知溶液中存在2n(Cu2+)+n(H+)=n(NO3-)计算.
| 6.4g |
| 64g/mol |
解答:
解:n(Cu)=
=0.1mol,与硝酸反应生成Cu2+,溶液中n(Cu2+)=0.1mol,
根据溶液的电荷守恒可知溶液中存在2n(Cu2+)+n(H+)=n(NO3-),氢氧根离子浓度较小,可忽略不计,
则n(NO3-)=2×0.1mol+amol=0.200mol+amol,
故选D.
| 6.4g |
| 64g/mol |
根据溶液的电荷守恒可知溶液中存在2n(Cu2+)+n(H+)=n(NO3-),氢氧根离子浓度较小,可忽略不计,
则n(NO3-)=2×0.1mol+amol=0.200mol+amol,
故选D.
点评:本题考查化学方程式的计算,题目难度不大,本题注意根据溶液的电荷守恒计算,本题还可以计算氮氧化物的物质的量,可根据N元素守恒计算.

练习册系列答案
相关题目
下列关于铝的叙述中,不正确的是( )
| A、铝有抗腐蚀性能是因为其表面能形成致密的氧化膜 |
| B、在高温下铝能将氧化铁中的铁置换出来 |
| C、氢氧化铝既能与强酸反应又能与强碱溶液反应 |
| D、常温下能用铝制容器盛放浓硝酸和浓硫酸,是因为铝在常温下不能与它们发生反应 |
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)△H=a kJ?mol-1其化学平衡常数K和温度t的关系如下表:下列说法中正确的是( )
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A、该反应的正反应为放热反应,即a<0 |
| B、当平衡浓度符合c(CO2)?c(H2)=c(CO)?c(H2O)时的温度为830℃ |
| C、当其他条件不变时,若缩小容器的体积,则有利于该反应平衡正向移动 |
| D、当v(H2)=v(H2O)时该反应达到化学平衡状态 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOG下列叙述不正确的是( )
| 放电 |
| 充电 |
| A、放电时负极反应为:Zn-2e+2OH=Zn(OH)2 |
| B、充电时阳极反应为:Fe(OH)3-3e+5OH-=FeO42-+4H2O |
| C、放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
| D、放电时正极附近溶液的碱性增强 |
我们食用的大豆最终补充给人体的主要成分是( )
| A、氨基酸 | B、糖类 |
| C、蛋白质 | D、油脂 |

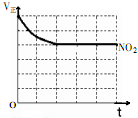 氮是大气中含量丰富的一种元素,请回答下列氦及其化合物的相关问题:
氮是大气中含量丰富的一种元素,请回答下列氦及其化合物的相关问题: