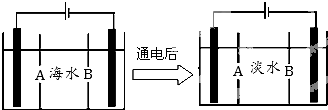
题目内容
13.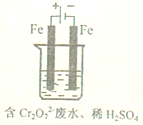 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.常用的处理方法有两种.
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法
该法的工艺流程为:CrO42-$→_{①转化}^{H+}$Cr2O72-$→_{②还原}^{Fe_{2}+}$Cr3+$→_{③沉淀}^{OH-}$Cr(OH)3
其中第①步存在平衡:2CrO42- (黄色)+2H+(g)?Cr2O72- (橙色)+2H2O
(1)若该平衡处于强酸性环境中,则溶液显橙色.
(2)能说明第①步达平衡状态的是cd.
a.Cr2O72-和CrO42-的浓度相同 b.2υ(Cr2O72-)=υ(CrO42-)
c.溶液的颜色不变 d.溶液的pH保持不变
(3)写出第②步反应的离子方程式Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O.
方法2:电解法
实验室用如图模拟含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀.
(4)阳极的电极材料为Fe,其作用是阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+.
(5)溶液中同时生成的沉淀还有Fe(OH)3,用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是8.48g.
分析 (1)根据外界条件对平衡的影响来确定平衡移动方向,从而确定溶液颜色变化;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡,也可根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
(3)Cr2O72-具有强氧化性把Fe2+氧化为Fe3+;
(4)阳极是活性电极时,阳极本身失电子,生成阳离子;
(5)溶液PH升高的原因是溶液中氢离子浓度减少,即氢离子在阴极得电子,PH升高,氢氧根离子浓度增大,离子浓度幂的乘积大于溶度积,所以金属阳离子会生成氢氧化物沉淀;根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,Cr3++3OH-═Cr(OH)3↓、Fe3++3OH-═Fe(OH)3↓进行计算.
解答 解:(1)c(H+)增大,平衡2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案为:橙;
(2)对于平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O,
a.Cr2O72-和CrO42-的浓度相同,不一定平衡,故错误;
b.2υ(Cr2O72-)=υ(CrO42-)不能证明正逆速率相等,所以不是平衡状态,故错误;
c.溶液的颜色不变,即有色离子浓度不会再不变,达到了化学平衡状态,故正确;
d.溶液的pH保持不变,即氢离子浓度不变,所以达到了化学平衡状态,故d正确;
故答案为:cd;
(3)Cr2O72-具有强氧化性把Fe2+氧化为Fe3+,其反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
故答案为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(4)在电解法除铬中,铁作阳极,阳极反应为Fe-2e-═Fe2+,以提供还原剂Fe2+,
故答案为:阳极反应为Fe-2e-=Fe2+,提供还原剂Fe2+;
(5)在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2:2H++2e-═H2↑,同时大量产生了OH-,所以溶液中的Fe3+也将转化为Fe(OH)3沉淀;根据Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,Cr3++3OH-═Cr(OH)3↓、Fe3++3OH-═Fe(OH)3↓知0.01mol Cr2O72-,可生成0.02molCr(OH)3,0.06molFe(OH)3,至少得到沉淀的质量是0.02mol×103g/mol+0.06mol×107g/mol=8.48g,
故答案为:Fe(OH)3;8.48g.
点评 本题主要考查了铬及其化合物的性质、氧化还原反应、沉淀溶解平衡和电化学知识等内容,难度中等,抓住题目信息是解题的关键,注意把握氧化还原反应原理以及电解时电极反应.

| A. | 凡是分子组成相差一个或若干个CH2原子团的物质,彼此一定是同系物 | |
| B. | 分子式为C5H12O且氧化产物能发生银镜反应的醇有6种 | |
| C. | 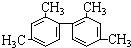 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| D. | 1mol β-紫罗兰酮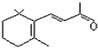 与1mol H2发生加成反应可得到3种不同产物 与1mol H2发生加成反应可得到3种不同产物 |
| A. | 产生CO2 | B. | 浓硫酸表现出脱水性 | ||
| C. | 放出大量的热 | D. | 浓硫酸表现出还原性 |
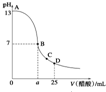 25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L -1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析不正确的是( )
25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L -1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析不正确的是( )| A. | B点的横坐标a>12.5 | |
| B. | C点时溶液中有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| D. | 曲线上A、B间的任意一点,溶液中都有:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| A. | 1 mol H2O所含有的原子数为3NA | |
| B. | 常温常压下,32g O2含有的氧原子数为2NA | |
| C. | 11.2L氯气所含的原子数为NA | |
| D. | 0.1mol•L -1NaCl溶液中c(Na+)为0.1 mol•L -1 |
 ;反应类型:加聚反应.
;反应类型:加聚反应. 叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O=NaN3+NaOH+NH3,3NaNH2+NaNO3=NaN3+3NaOH+NH3↑.
叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O=NaN3+NaOH+NH3,3NaNH2+NaNO3=NaN3+3NaOH+NH3↑. .
.