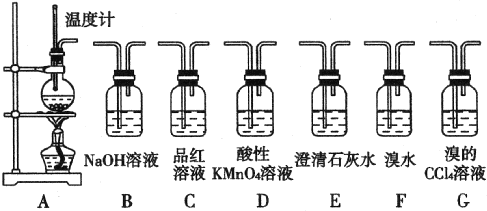
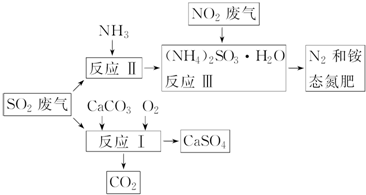
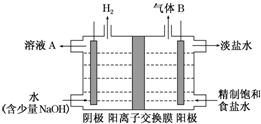
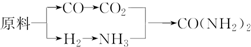题目内容
5.乙烯、苯和溴乙烷是重要的有机化工原料,完成下列反应方程式和反应类型.(1)一定条件下乙烯和水反应:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3-CH2-OH,反应类型:加成反应.
(2)乙烯合成高分子材料聚乙烯:nCH2═CH2$\stackrel{催化剂}{→}$
 ;反应类型:加聚反应.
;反应类型:加聚反应.(3)苯和液溴在铁粉催化下反应:C6H6+Br2$\stackrel{铁}{→}$C6H5Br+HBr,反应类型:取代反应.
(4)溴乙烷在氢氧化钠的乙醇溶液中加热:CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+NaBr+H2O,反应类型:消去反应.
分析 (1)乙烯与水加成生成乙醇;
(2)乙烯含碳碳双键,能够与溴发生加成反应;能够发生加聚反应生成聚乙烯;
(3)在催化剂作用下,苯与液溴发生取代反应生成了溴苯和溴化氢;
(4)溴乙烷在氢氧化钠的醇溶液中共热,发生消去反应生成乙烯;
解答 解:(1)乙烯与水加成生成乙醇,方程式:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3-CH2-OH,属于加成反应;
故答案为:CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3-CH2-OH,加成反应;
(2)乙烯含有碳碳双键,在催化剂的条件下发生加聚反应生成聚乙烯,方程式为:nCH2═CH2$\stackrel{催化剂}{→}$ ,属于加聚反应,
,属于加聚反应,
故答案为:nCH2═CH2$\stackrel{催化剂}{→}$ ,加聚反应;
,加聚反应;
(3)苯和液溴在催化剂条件下能发生取代反应生成溴苯,反应方程式为:C6H6+Br2$\stackrel{铁}{→}$C6H5Br+HBr,属于取代反应,
故答案为:C6H6+Br2$\stackrel{铁}{→}$C6H5Br+HBr,取代反应;
(4)溴乙烷与氢氧化钠的乙醇溶液反应生成乙烯,反应的化学方程式为CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+NaBr+H2O,属于消去反应,
故答案为:CH3CH2Br+NaOH$→_{△}^{醇}$CH2=CH2↑+NaBr+H2O,消去反应;
点评 本题考查有机物的机构和性质,注意把握有机物的官能团的性质以及相关方程式的书写是解题关键,注意有机反应类型的判断.

练习册系列答案
相关题目
16.在密闭容器中加入2.0mol SO2和1.0mol O2,一定条件下发生如下反应2SO2+O2?2SO3.反应达到平衡后,各物质的物质的量可能为( )
| n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
| A | 2.0 | 1.0 | 0 |
| B | 1.0 | 0 | 1.0 |
| C | 0.20 | 0.10 | 1.80 |
| D | 0 | 0 | 2.0 |
| A. | A | B. | B | C. | C | D. | D |
20.有CH3OH、CH3COOH和丙三醇(C3H8O3)组成的混合液体,其中碳的质量分数39%,则氢的质量分数为( )
| A. | 6.7% | B. | 8.7% | C. | 9% | D. | 12.5% |
 ;
; ;
;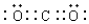 ;
; ;
;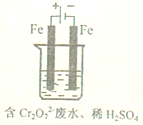 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.常用的处理方法有两种.
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.常用的处理方法有两种.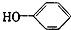 合成
合成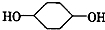 (部分试剂和反应条件已略去)
(部分试剂和反应条件已略去)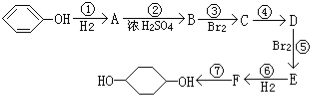
 ;F中含有官能团的名称为溴原子.
;F中含有官能团的名称为溴原子.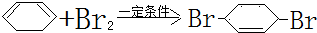 ,写出在同样反应条件下
,写出在同样反应条件下 的化学方程式(有机物写结构简式,注明反应条件)
的化学方程式(有机物写结构简式,注明反应条件)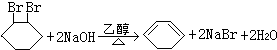 .
.