题目内容
用惰性电极电解硫酸铜溶液一段时间后,向溶液中加入1mol Cu(OH)2后恰好恢复到原来浓度,下列说法不正确的是( )
| A、阴极产物是Cu和H2 |
| B、阳极共产生11.2L的O2 |
| C、电解过程中溶液的PH值不断减小 |
| D、电解过程中电子转移数目4NA |
考点:电解原理
专题:电化学专题
分析:根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入1mol Cu(OH)2后溶液与电解前相同,1mol Cu(OH)2从组成上可看成1molCuO?H2O,所以实际上相当于加入的物质是1mol氧化铜和1mol水,电解发生2H2O+2CuSO4
2Cu+O2↑+2H2SO4 ,2H2O
O2↑+2H2↑,以此来解答.
| ||
| ||
解答:
解:加入1mol Cu(OH)2后溶液与电解前相同,1mol Cu(OH)2从组成上可看成1molCuO?H2O,所以实际上相当于加入的物质是1mol氧化铜和1mol水,电解发生2H2O+2CuSO4
2Cu+O2↑+2H2SO4 ,2H2O
O2↑+2H2↑,
A.根据以上分析,电解时阴极上先是铜离子得电子生成铜,后氢离子得电子生成氢气,所以产物是Cu和H2,故A正确;
B.电解时阳极一直是氢氧根失电子上生成氧气,无标准状态,所以不一定产生11.2L的O2,故B错误;
C.根据电解过程先发生2H2O+2CuSO4
2Cu+O2↑+2H2SO4 ,生成酸PH值不断减小,后发生2H2O
O2↑+2H2↑酸浓度不段增大,PH值也不断减小,故C正确;
D.加入1mol Cu(OH)2后溶液与电解前相同,1mol Cu(OH)2从组成上可看成1molCuO?H2O,所以实际上相当于加入的物质是1mol氧化铜和1mol水,则转移电子的物质的量是1mol×(2-0)+1mol×2=4mol,故D正确;
故选B.
| ||
| ||
A.根据以上分析,电解时阴极上先是铜离子得电子生成铜,后氢离子得电子生成氢气,所以产物是Cu和H2,故A正确;
B.电解时阳极一直是氢氧根失电子上生成氧气,无标准状态,所以不一定产生11.2L的O2,故B错误;
C.根据电解过程先发生2H2O+2CuSO4
| ||
| ||
D.加入1mol Cu(OH)2后溶液与电解前相同,1mol Cu(OH)2从组成上可看成1molCuO?H2O,所以实际上相当于加入的物质是1mol氧化铜和1mol水,则转移电子的物质的量是1mol×(2-0)+1mol×2=4mol,故D正确;
故选B.
点评:本题考查电解原理,为高频考点,把握“加入1molCu(OH)2充分反应后,溶液恰好恢复到电解前的状态”发生的电解反应过程为解答的关键,侧重电极反应、原子守恒及转移电子计算的考查,题目难度不大.

练习册系列答案
相关题目
现有含金属元素An+的溶液,c(An+)=0.80mol?L-1.取该溶液10mL恰好把20mL 0.40mol?L-1的Na2CO3(aq)中的CO32-全部沉淀.已知上述10mL溶液中含此金属阳离子0.32g,则该金属的相对原子质量为( )
| A、24 | B、32 | C、40 | D、64 |
下列叙述中,能证明某物质是弱电解质的是( )
| A、熔化时不导电 |
| B、不是离子化合物,而是极性共价化合物 |
| C、溶液中已电离的离子和未电离的分子共存 |
| D、水溶液的导电能力很差 |
氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为( )
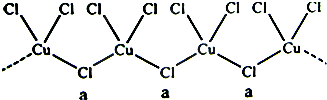

| A、sp杂化 |
| B、sp2杂化 |
| C、sp3杂化 |
| D、dsp2杂化 |
下列说法中,正确的是( )
| A、钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
| B、氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- |
| C、电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ |
| D、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ |