题目内容
已知H2S两级电离常数分别为K1=1.3×10-7,K2=7.1×10-15;CH3COOH的电离常数K=1.75×10-5,试根据上述数据,判断下列化学反应方程式正确的是( )
| A、Na2S+2CH3COOH(足量)=2CH3COONa+H2S↑ |
| B、Na2S+2CH3COOH(少量)=2CH3COONa+H2S↑ |
| C、Na2S(少量)+CH3COOH=CH3COONa+NaHS |
| D、CH3COOH+NaHS=CH3COONa+H2S↑ |
考点:弱电解质在水溶液中的电离平衡,化学方程式的书写
专题:
分析:根据电离常数的大小可以确定酸的强弱,化学反应遵循强酸制取弱酸的原理,据此确定反应能否发生.
解答:
解:H2S两级电离常数分别为K1=1.3×10-7,K2=7.1×10-15,CH3COOH的电离常数K=1.75×10-5,得到酸性顺序是CH3COOH>H2S>HS-,
A、酸性顺序是:CH3COOH>H2S>HS-,反应为Na2S+2CH3COOH(足量)=2CH3COONa+H2S↑能发生,故A正确;
B、酸性顺序是:CH3COOH>H2S>HS-,发生反应为Na2S+CH3COOH(少量)=CH3COONa+NaHS,故B错误;
C、Na2S(少量)+2CH3COOH=2CH3COONa+H2S↑,故C错误;
D、酸性顺序是:CH3COOH>H2S>HS-,反应CH3COOH+NaHS=CH3COONa+H2S↑能发生,故D正确.
故选AD.
A、酸性顺序是:CH3COOH>H2S>HS-,反应为Na2S+2CH3COOH(足量)=2CH3COONa+H2S↑能发生,故A正确;
B、酸性顺序是:CH3COOH>H2S>HS-,发生反应为Na2S+CH3COOH(少量)=CH3COONa+NaHS,故B错误;
C、Na2S(少量)+2CH3COOH=2CH3COONa+H2S↑,故C错误;
D、酸性顺序是:CH3COOH>H2S>HS-,反应CH3COOH+NaHS=CH3COONa+H2S↑能发生,故D正确.
故选AD.
点评:电离常数的大小可以确定酸的强弱,化学反应遵循强酸制取弱酸的原理是解答此题的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列叙述正确的是( )
| A、1 mol H2O的质量为18 g?mol-1 |
| B、3.01×1023个SO2分子的质量为32 g |
| C、CH4的摩尔质量为16 g |
| D、1 mol任何物质均含有6.02×1023个分子 |
氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为( )
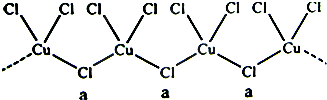

| A、sp杂化 |
| B、sp2杂化 |
| C、sp3杂化 |
| D、dsp2杂化 |
下列说法中,正确的是( )
| A、钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+ |
| B、氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- |
| C、电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ |
| D、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ |
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.下列表述中不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.下列表述中不正确的是( )| A、X位于元素周期表中第三周期第IA 族 |
| B、W的基态原子核外有2个未成对电子 |
| C、X的单质和Y的单质相比,熔点较高的是X |
| D、Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是SiCl4+3H2O=H2SiO3↓+4HCl |

 (Ⅰ) 在一个容积固定不变的密闭容器中进行反应:
(Ⅰ) 在一个容积固定不变的密闭容器中进行反应: