题目内容
4.为了证明(NH4)2Fe(SO4)2•6H2O(硫酸亚铁铵晶体)的成分中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是( )| A. | 取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水 | |
| B. | 硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+ | |
| C. | 硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- | |
| D. | 取少量硫酸亚铁铵晶体放入试管,加入浓氢氧化钠溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有NH4+ |
分析 A、(NH4)2Fe(SO4)2•6H2O(硫酸亚铁铵晶体)加热失去结晶水;
B、亚铁离子溶解形成的溶液呈浅绿色,被氧化为三价铁离子,遇到硫氰酸钾变血红色;
C、依据硫酸根离子的检验方法分析判断;
D、少量稀NaOH溶液时不会放出氨气,应该“大量浓NaOH并加热”才可以.
解答 解:A、晶体加热后生成液体可以判断是生成的水,证明晶体中含结晶水,故A正确;
B、溶液呈浅绿色证明试样溶液中含有Fe2+ 滴入KSCN溶液,溶液不显红色,再向试管中滴加几滴新配制的氯水,溶液的颜色变为红色,说明有Fe3+存在,这个结果间接地说明在原溶液中有Fe2+存在,故B正确;
C、加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42-,这是硫酸根离子的检验方法,故C正确;
D、应取少量样品于试管中,加入浓NaOH溶液,并适当加热,若产生的气体能使湿润的蓝色石蕊试纸变红,即产生NH3,则证明硫酸亚铁铵中含有NH4+,故D错误;
故选D.
点评 本题考查物质的鉴定.能熟悉常见结晶水合物的颜色;溶液中各种水合离子的颜色;熟练掌握常见离子的检验方法与操作.

练习册系列答案
相关题目
13.下列有关化学用语表示正确的是( )
| A. | 碳酸的电离方程式:H2CO3═2H++CO32- | |
| B. | NaHSO4(溶液)的电离:NaHSO4═Na++H++SO42- | |
| C. | 亚硫酸钠水解的离子方程式:SO32-+2H2O?H2SO3+2OH- | |
| D. | HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+ |
9.水的相对分子质量为18,则一个水分子的质量为( )
| A. | $\frac{18}{{N}_{A}}$ | B. | $\frac{18}{{N}_{A}}$g•mol-1 | C. | 18NA g | D. | $\frac{18}{{N}_{A}}$g |
16.下列物质的转化均能通过一步反应实现的是( )
| A. | NaAlO2→Al(OH)3→Al | B. | N2→NO2→HNO3 | ||
| C. | NaOH→Na2CO3→NaHCO3 | D. | FeS2→SO3→H2SO4 |
13.下列离子方程式不正确的是( )
| A. | 碳酸钙与稀盐酸混合:CO32-+2H+=CO2↑+H2O | |
| B. | 硫酸铜溶液与烧碱溶液混合:Cu2++2OH-=Cu(OH)2↓ | |
| C. | 碳酸氢钠与稀盐酸混合:HCO3-+H+=CO2↑+H2O | |
| D. | 铁粉跟稀盐酸反应 2Fe+6H+=2Fe3++3H2↑ |
 反应是 ( )
反应是 ( )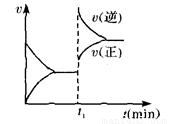
 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0 从环己烷可制备1,4-环己二醇,下列有关7步反应(其中无机产物都已略去),其中有2步属于取代反应,2步属于消去反应,3步属于加成反应.试回答:
从环己烷可制备1,4-环己二醇,下列有关7步反应(其中无机产物都已略去),其中有2步属于取代反应,2步属于消去反应,3步属于加成反应.试回答: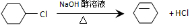 ;
; .
. ,C
,C .
.