题目内容
已知下列热化学方程式:2H2O(g)═2H2(g)+O2(g)△H=+483.6kJ/mol,2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol.当1g水由液态变为气态时,其热量变化是( )
①吸热 ②放热 ③2.44kJ ④88kJ.
①吸热 ②放热 ③2.44kJ ④88kJ.
| A、①④ | B、②④ | C、①③ | D、②③ |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:当1g 液态水变成气态水时,需要吸热,依据盖斯定律计算得到液态水变化为气体水吸收的热量,依据热化学方程式计算1g水变化为气态水吸收的热量.
解答:
解:当1g 液态水变成气态水时,需要吸热,依据盖斯定律计算得到液态水变化为气体水吸收的热量;
已知热化学方程式:①2H2O(g)═2H2(g)+O2(g)△H=+483.6kJ/mol,
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol.
依据盖斯定律①+②得到2H2O(g)=2H2O(l);△H3=-88KJ/mol,则2H2O(l)=2H2O(g);△H3=+88KJ/mol,依据热化学方程式计算,当1g 液态水变成气态水时,需要吸热
KJ=2.44KJ;
所以①③正确;
故选C.
已知热化学方程式:①2H2O(g)═2H2(g)+O2(g)△H=+483.6kJ/mol,
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol.
依据盖斯定律①+②得到2H2O(g)=2H2O(l);△H3=-88KJ/mol,则2H2O(l)=2H2O(g);△H3=+88KJ/mol,依据热化学方程式计算,当1g 液态水变成气态水时,需要吸热
| 88 |
| 36 |
所以①③正确;
故选C.
点评:本题考查了热化学方程式的书写方法和盖斯定律的计算,注意热化学方程式系数变化焓变随之变化,反应改变方向,焓变改变符号,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
根据物质的熔点、沸点数据,推断错误的是( )
| 晶体 | NaCl | MgO | AlCl3 | SiCl4 | B(硼) |
| 熔点℃ | 801 | 2852 | 180 | -70 | 2300 |
| 沸点℃ | 1465 | --- | 177 | 57 | 2500 |
| A、晶体的沸点CCl4<SiCl4 |
| B、在火山喷出的岩浆,晶出顺序为MgO先于NaCl |
| C、用AlCl3通过电解法冶炼铝 |
| D、硼的硬度大,不溶于水,但能与NaOH溶液反应 |
胶体区别于其它分散系的本质特征是( )
| A、微粒的直径为1nm~100nm |
| B、透明、稳定 |
| C、有丁达尔现象 |
| D、具有粘性 |
下列关于图的实验装置说法正确的是( )
A、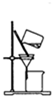 该图装置可以提纯精制氢氧化铁胶体 |
B、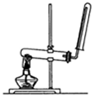 该图装置可以用来制备和收集氨气和氧气 |
C、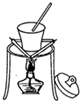 该图可以从食盐水中得到食盐晶体 |
D、 该图试管中放新制FeSO4溶液,从滴管中滴加NaOH溶液,易于观察到Fe(OH)2颜色 |
用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中,正确的是( )


| A、电池工作时,正极反应式为:O2+2 H2O+4e-=4OH- |
| B、忽略能量损耗,当电池中消耗0.02g H2时,a极周围会产生0.02g H2 |
| C、电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D、电解时,a 电极周围首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl- |
下列表示对应化学反应的离子方程式正确的是( )
A、向氯化铝溶液通入过量的氨气:Al3++4OH-═
| ||||
B、MnO2与浓盐酸反应制Cl2:MnO2+4HCl
| ||||
| C、FeCl3溶液用于蚀刻印刷电路:Cu+2Fe3+=Cu2++2Fe2+ | ||||
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ |
下列离子反应方程式正确的是( )
| A、Na2O2 与水反应:2O22-+2H2O=4OH-+O2↑ |
| B、NaHCO3与盐酸:CO32-+2H+=H2O+CO2↑ |
| C、Ca(HCO3)2与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
| D、醋酸与小苏打溶液反应H++HCO3-=CO2↑+H2O |
 A~G的转化关系如图所示(部分反应物、产物和反应条件未标出).
A~G的转化关系如图所示(部分反应物、产物和反应条件未标出).