题目内容
已知硫化亚铜与一定浓度的硝酸共热,所得溶液中只有硝酸铜和硫酸铜,放出一氧化氮和二氧化氮两种气体,且两种气体的物质的量之比为3:7,则参加反应的硫化亚铜和作氧化剂的硝酸的物质的量之比是( )
| A、4:25 | B、2:17 |
| C、1:7 | D、3:8 |
考点:化学方程式的有关计算
专题:计算题
分析:令NO、NO2的物质的量分别为3mol、7mol,起氧化剂作用的硝酸生产NO、NO2,根据N原子守恒计算起氧化剂作用的硝酸,根据电子转移守恒计算Cu2S的物质的量,据此解答.
解答:
解:令NO、NO2的物质的量分别为3mol、7mol,起氧化剂作用的硝酸生产NO、NO2,根据N原子守恒,起氧化剂作用的硝酸为3mol+7mol=10mol,根据电子转移守恒,参加反应的Cu2S的物质的量为
=1.6mol,则参加反应的硫化亚铜和作氧化剂的硝酸的物质的量之比为1.6mol:10mol=4:25,
故选A.
| 3mol×3+7mol×1 |
| 8+2 |
故选A.
点评:本题考查硝酸性质、氧化还原反应计算,难度中等,注意利用守恒思想进行解答.

练习册系列答案
相关题目
已知下列热化学方程式:2H2O(g)═2H2(g)+O2(g)△H=+483.6kJ/mol,2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol.当1g水由液态变为气态时,其热量变化是( )
①吸热 ②放热 ③2.44kJ ④88kJ.
①吸热 ②放热 ③2.44kJ ④88kJ.
| A、①④ | B、②④ | C、①③ | D、②③ |
下列叙述正确的是( )
| A、副族元素没有非金属元素 |
| B、除短周期外,其他周期均含18种元素 |
| C、碱金属元素是指ⅠA族的所有元素 |
| D、同周期第ⅡA族和第ⅢA族的元素,原子序数只相差1或11 |
能区别[Co(NH3)4Cl2]Cl和[Co(NH3)4Cl2]NO3两种溶液的试剂是( )
| A、浓氨水 |
| B、NaOH溶液 |
| C、CCl4 |
| D、AgNO3溶液 |
下列化学用语不正确的是:( )
| A、乙烯的结构简式:CH2=CH2 |
B、二氧化硫分子比例模型: |
| C、漂粉精的主要成分:CaCl2 |
| D、HCN分子的结构式:H-C≡N |
体积相同的甲乙两容器中,一个充满HCl,另一个充满H2和Cl2的混合气体.同温、同压下,两个容器内的气体一定具有相同的( )
| A、原子总数 | B、分子总数 |
| C、质量 | D、密度 |
关于下列各装置图的叙述中,正确的是( )
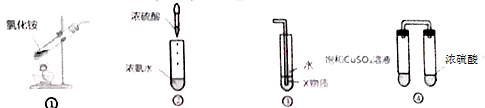

| A、实验室用装置①制取氨气 |
| B、装置②的原理可以制取氨气 |
| C、装置③中X若为四氯化碳,不可用于吸收氨气,并防止倒吸 |
| D、装置④放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
下列实验方法能达到实验目的是( )
| A、向某无色溶液中先加入氯化钡溶液,生成白色沉淀,在加入足量盐酸,沉淀不溶解,说明原溶液中含有SO42- |
| B、用分液的方法分离溴和CCl4的混合物 |
| C、用水鉴别苯,四氯化碳,酒精三种液体 |
| D、用向上排空气法收集NO |
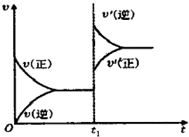 往一体积不变的密闭容器中充入H2(g)+I2(g)?2HI(g);△H<0,当达到平衡后,t1时,若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是( )
往一体积不变的密闭容器中充入H2(g)+I2(g)?2HI(g);△H<0,当达到平衡后,t1时,若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是( )| A、t1时,减小体积或升高体系温度 |
| B、平衡不移动,混合气体的密度增大 |
| C、H2的转化率增大,HI的平衡浓度减小 |
| D、容器内气体颜色变深,平均相对分子质量不变 |