题目内容
测血钙的含量时,可将2.0mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀.将沉淀用稀硫酸处理得H2C2O4后,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+,若到终点时用去20.0mL 1.0×10-4 mol?L-1的KMnO4溶液.
(1)写出用KMnO4滴定H2C2O4的离子方程式 .
(2)判断滴定终点的方法是 .
(3)计算:血液中含钙离子的浓度为多少(单位为g?mL-1,写出计算过程).
(1)写出用KMnO4滴定H2C2O4的离子方程式
(2)判断滴定终点的方法是
(3)计算:血液中含钙离子的浓度为多少(单位为g?mL-1,写出计算过程).
考点:探究物质的组成或测量物质的含量,中和滴定
专题:实验题
分析:(1)高锰酸钾具有强氧化性,在硫酸条件下将H2C2O4氧化为CO2,自身被还原为MnSO4,据此写出反应的滤渣方程式;
(2)高锰酸钾溶液本身有颜色,为紫色,在开始滴入草酸中时被还原,颜色消失,当达到滴定终点时,加入最后一滴高锰酸钾溶液颜色不褪去,溶液应该是由无色变为浅紫色;
(3)利用有关反应的方程式可以得出关系式:5Ca2+~2KMnO4,据此计算.
(2)高锰酸钾溶液本身有颜色,为紫色,在开始滴入草酸中时被还原,颜色消失,当达到滴定终点时,加入最后一滴高锰酸钾溶液颜色不褪去,溶液应该是由无色变为浅紫色;
(3)利用有关反应的方程式可以得出关系式:5Ca2+~2KMnO4,据此计算.
解答:
解:(1)高锰酸钾具有强氧化性,在硫酸条件下将H2C2O4氧化为CO2,自身被还原为MnSO4,反应方程式为2KMnO4+5H2C2O4+3H2SO4═2MnSO4+K2SO4+10CO2↑+8H2O,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故答案为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
(2)高锰酸钾溶液本身有颜色,为紫色,在开始滴入草酸中时被还原,颜色消失,当达到滴定终点时,加入最后一滴高锰酸钾溶液颜色不褪去,溶液由无色变为浅紫色,且半分钟内不褪色,
故答案为:溶液由无色变为浅紫色,且半分钟内不褪色;
(3)由CaC2O4+H2SO4═CaSO4+H2C2O4、2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可以得出关系式:5Ca2+~2KMnO4,所以n(Ca2+)=2.5n(KMnO4)=1.0×10-4mol/L×0.02L×2.5,所以可计算出2 mL该血液中含钙的质量为:1.0×10-4mol/L×0.02L×2.5×40g/mol=2×10-4g,1mL该血液中含钙:
=
1.0×10-4 g?mL-1,
答:血液中含钙离子的浓度为1.0×10-4 g?mL-1.
(2)高锰酸钾溶液本身有颜色,为紫色,在开始滴入草酸中时被还原,颜色消失,当达到滴定终点时,加入最后一滴高锰酸钾溶液颜色不褪去,溶液由无色变为浅紫色,且半分钟内不褪色,
故答案为:溶液由无色变为浅紫色,且半分钟内不褪色;
(3)由CaC2O4+H2SO4═CaSO4+H2C2O4、2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可以得出关系式:5Ca2+~2KMnO4,所以n(Ca2+)=2.5n(KMnO4)=1.0×10-4mol/L×0.02L×2.5,所以可计算出2 mL该血液中含钙的质量为:1.0×10-4mol/L×0.02L×2.5×40g/mol=2×10-4g,1mL该血液中含钙:
| 2×10-4g |
| 2mL |
1.0×10-4 g?mL-1,
答:血液中含钙离子的浓度为1.0×10-4 g?mL-1.
点评:本题考查化学方程式书写、氧化还原反应、滴定应用、化学计算等,难度中等,是对所需知识的综合运用,需要学生具有扎实的基础知识与分析问题、解决问题的能力.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
短周期元素X、Y、Z原子序数依次增大,X原子的核外电子数与Y原子的最外层电子数相等,Y原子的最外层电子数是内层电子数的3倍,Z的原子半径大于Y,Z与R能形成离子化合物RZ2,且两种离子具有相同的电子层结构.下列判断正确的是( )
| A、X与Y形成的分子中既含有极性共价键又含有非极性共价键 |
| B、X的气态氢化物比Y的气态氢化物稳定 |
| C、X与R、Y与R均能形成阴阳离子数目之比为1:1的化合物 |
| D、R、X、Y三种元素可形成化学式为RXY3、R(X2Y4)2的两种盐 |
一种气态烷烃和一种气态烯烃的混合物共14.3g,同温同压下,该混合气体密度为氢气密度的11倍,将混合气通过足量溴水,溴水增重6.3g.则混合气中的烃分别是( )
| A、甲烷和乙烯 |
| B、甲烷和丙烯 |
| C、甲烷和丁烯 |
| D、乙烷和丙烯 |
 所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式
所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式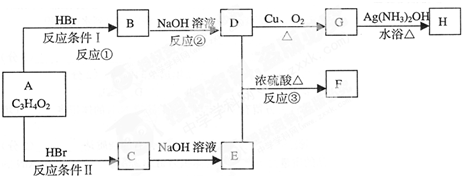

 某同学在探究常见物质转化时,发现部分物质间可存在如图所示的三角转换关系.已知:
某同学在探究常见物质转化时,发现部分物质间可存在如图所示的三角转换关系.已知: