题目内容
一种气态烷烃和一种气态烯烃的混合物共14.3g,同温同压下,该混合气体密度为氢气密度的11倍,将混合气通过足量溴水,溴水增重6.3g.则混合气中的烃分别是( )
| A、甲烷和乙烯 |
| B、甲烷和丙烯 |
| C、甲烷和丁烯 |
| D、乙烷和丙烯 |
考点:有机物的推断
专题:有机物的化学性质及推断
分析:混合气体的平均相对分子质量=11×2=22,由于烯烃中乙烯的相对分子质量最小为28,故混合气体中一定有甲烷,该混合气通过Br2水时,Br2水增重6.3g为烯烃的质量,计算甲烷的质量,进而计算甲烷的物质的量,再计算烯烃的物质的量,结合烯烃的质量来确定烯烃的摩尔质量,根据烯烃组成通式确定烯烃.
解答:
解:混合气体的平均相对分子质量=11×2=22,由于烯烃中乙烯的相对分子质量最小为28,故混合气体中一定有甲烷,该混合气通过Br2水时,Br2水增重6.3g为烯烃的质量,所以甲烷的质量为14.3g-6.3g=8g,甲烷的物质的量为
=0.5mol,
混合气体的总的物质的量为
=0.65mol,故烯烃的物质的量为0.65mol-0.5mol=0.15mol,所以M(烯烃)=
=42g?mol-1,令烯烃的组成为CnH2n,则14n=42,所以n=3,故为丙烯,所以混合物为甲烷、丙烯,
故选B.
| 8g |
| 16g/mol |
混合气体的总的物质的量为
| 14.3g |
| 22g/mol |
| 6.3g |
| 0.15mol |
故选B.
点评:本题考查有机物分子式的确定、烯烃的性质等,难度中等,根据平均摩尔质量确定含有甲烷是解题的关键.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
X、Y、Z均为第三周期元素,X的第一电离能在同周期中最小,Y的电负性在同周期中最大,Z的离子半径在同周期中最小,下列关于X、Y、Z叙述中不正确的是( )
| A、元素Y形成的气态氢化物水溶液呈强酸性 |
| B、元素X与元素Y能形成离子化合物 |
| C、元素Z最高价氧化物对应水化物具有两性 |
| D、离子半径大小顺序均为:X>Y>Z |
实验室测定绿矾中FeSO4?7H2O的质量分数.称1g绿矾样品溶解在300mL水中,再加入硫酸和磷酸.用0.02
mol/L KMnO4溶液滴定至溶液变粉红色,消耗KMnO4溶液VmL;已知:①MnO4-+aFe2++2bH+=Mn2++aFe3++bH2O;②Fe3+(黄色)+2H3PO4=H3[Fe(PO4)2](无色)+3H+;③FeSO4?7H2O的相对分子质量为278.下列叙述正确的是( )
mol/L KMnO4溶液滴定至溶液变粉红色,消耗KMnO4溶液VmL;已知:①MnO4-+aFe2++2bH+=Mn2++aFe3++bH2O;②Fe3+(黄色)+2H3PO4=H3[Fe(PO4)2](无色)+3H+;③FeSO4?7H2O的相对分子质量为278.下列叙述正确的是( )
| A、反应①中a的值为5,b的值为8 |
| B、该滴定过程中选择的指示剂是酚酞 |
| C、样品中w(FeSO4?7H2O)=2.78V×100% |
| D、反应②是为了消除Fe3+的棕黄色对终点判断的干扰 |
研究某一化学反应的实验装置如图:实验中产生的主要现象有:(1)D物质由黑色变成红色 (2)无水硫酸铜粉末放入无色透明的E中得到蓝色溶液 (3)F中的气体可用于工业合成氨.通过分析,A和B可能是( )

| A、浓硫酸和铜粒 |
| B、浓氨水和氧化钙 |
| C、浓盐酸和浓硫酸 |
| D、水和电石 |

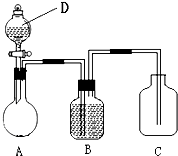 为确认C6H5OH、H2CO3、CH3COOH的酸性强弱,某同学设计了如图所示装置,一次实验即可达到目的(不必选用其他酸性物质).请据此实验回答下列问题:
为确认C6H5OH、H2CO3、CH3COOH的酸性强弱,某同学设计了如图所示装置,一次实验即可达到目的(不必选用其他酸性物质).请据此实验回答下列问题: