题目内容
17.设NA表示阿伏加德罗常数的数值,下列叙述中正确的是( )| A. | 2 L浓度为0.5 mol/L 硫酸溶液中含有NA个氢离子 | |
| B. | 1molFeCl3与沸水反应生成NA个Fe(OH)3胶粒 | |
| C. | 由14g CO中含有的原子数为NA | |
| D. | 在H2O2+Cl2═2HCl+O2反应中,每生成32 g氧气,转移电子数4 NA |
分析 A、硫酸溶液中,除了硫酸外,水也能电离出氢离子;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
C、求出CO的物质的量,然后根据CO为双原子分子来分析;
D、在H2O2+Cl2═2HCl+O2反应中,氧元素由-1价变为0价.
解答 解:A、硫酸的物质的量n=CV=0.5mol/L×2L=1mol,而硫酸为二元强酸,故由硫酸电离出的氢离子的个数为2NA个,而硫酸溶液中,除了硫酸外,水也能电离出氢离子,故溶液中的氢离子的个数大于2NA个,故A错误;
B、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故1mol氯化铁形成的胶粒的个数小于NA个,故B错误;
C、14gCO的物质的量为0.5mol,而CO为双原子分子,故0.5molCO中含NA个原子,故C正确;
D、在H2O2+Cl2═2HCl+O2反应中,氧元素由-1价变为0价,故当生成32g氧气即1mol氧气时,转移2mol电子即2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | 按系统命名法,化合物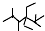 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| C. | 1 mol乙酸在浓H2SO4存在下与足量乙醇反应可得1 mol乙酸乙酯 | |
| D. | 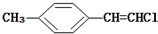 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
5.下列有机物的名称错误的是( )
| A. | 3,4,4-三甲基己烷 | B. | 3-乙基-1-丁烯 | ||
| C. | 1,2-二甲苯 | D. | 3-甲基-1-丁炔 |
9.目前海水提溴的最主要方法之一是空气吹出法工艺,其流程图如下:
含Br2的海水$\stackrel{①空气吹出}{→}$含Br2的空气$\stackrel{②SO_{2}吸收}{→}$吸收液$\stackrel{③氯化}{→}$溴水混合物$\stackrel{④蒸馏}{→}$液溴以下推断不合理的是( )
含Br2的海水$\stackrel{①空气吹出}{→}$含Br2的空气$\stackrel{②SO_{2}吸收}{→}$吸收液$\stackrel{③氯化}{→}$溴水混合物$\stackrel{④蒸馏}{→}$液溴以下推断不合理的是( )
| A. | 热空气能吹出溴是利用溴易挥发的性质 | |
| B. | SO2吸收溴的反应方程式:SO2+2H2O+Br2→H2SO4+2HBr | |
| C. | 流程中循环利用的物质有SO2、Br2、Cl2等多种 | |
| D. | 没有采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能 |
6.下列说法正确的是( )
| A. | 向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 | |
| B. | 欲除去Cl2中少量的HCl气体,可将此混合气体通过盛有饱和食盐水的洗气瓶 | |
| C. | 漂白粉的有效成分是CaCl2和Ca(ClO)2 | |
| D. | 自来水可以直接养金鱼 |
7.下列描述的化学反应状态,不一定是平衡状态的是( )
| A. | H2(g)+Br2(g)?2HBr(g) 恒温、恒容下,反应体系中气体的颜色保持不变 | |
| B. | 2NO2(g)?N2O4(g) 恒温、恒容下,反应体系中气体的压强保持不变 | |
| C. | CaCO3(s)?CO2(g)+CaO(s) 恒温、恒容下,反应体系中气体的密度保持不变 | |
| D. | 3H2(g)+N2(g)?2NH3(g) 反应体系中H2与N2的物质的量之比保持3:1 |
 .
.