题目内容
10.m mL 0.25mol/L的AlCl3溶液中加入金属钾,完全反应后,恰好只形成KCl和KAlO2溶液,则加入钾的物质的量( )| A. | 2.5×10-4m mol | B. | 5.0×10-4m mol | C. | 7.5×10-4m mol | D. | 1×10-3m mol |
分析 根据Cl元素守恒有n(KCl)=3n(AlCl3),根据Al元素守恒有n(KAlO2)=n(AlCl3),根据K元素守恒有n(K)=n(KCl)+n(KAlO2),再根据质量守恒计算加入金属钾的物质的量.
解答 解:m mL 0.25mol/L的AlCl3溶液中n(AlCl3)=0.001mL×0.25mol/L=0.00025m mol,
根据Cl元素守恒有:n(KCl)=3n(AlCl3)=3×0.00025m mol=0.00075m mol,
根据Al元素守恒有n(KAlO2)=n(AlCl3)=0.00025m mol,
所以n(K)=n(KCl)+n(KAlO2)=0.00075m mol+0.00025mmol=0.001m mol,
则加入的K的物质的量为0.001m mol=1×10-3m mol,
故选D.
点评 本题考查化学方程式的计算,题目难度中等,注意从元素守恒的角度解答较为简单,可省去书写化学方程式的中间过程,试题培养了学生的化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列说法错误的是( )
| A. | 液氨汽化时要吸收大量的热,常用作制冷剂 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾的有效措施 | |
| C. | 手机外壳上贴的碳纤维外膜是一种新型的无机非金属材料 | |
| D. | 纯碱可用于生产普通玻璃,也可用来治疗胃酸过多的病症 |
18.常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )
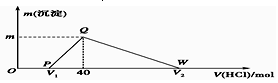

| A. | 原合金质量为0.92 g | |
| B. | 图中V2为60 | |
| C. | 整个滴定过程中Na+的浓度保持不变 | |
| D. | OP段发生的反应为:NaOH+HCl═NaCl+H2O |
5.pH=1的无色溶液中,下列离子一定能大量共存的是( )
| A. | NH4+、Ag+、PO43-、Cl- | B. | Al3+、H+、I-、HCO3- | ||
| C. | K+、Na+、NO3-、MnO4- | D. | Al3+、Mg2+、SO42-、NO3- |
15.已知Fe3O4 可表示成(FeO•Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+4OH-═Fe3O4+S4O62-+2H2O,下列说法不正确的是( )
| A. | O2是氧化剂,S2O32-、Fe2+ 是还原剂 | |
| B. | 当有1 mol Fe3O4生成时共转移的电子为4mol | |
| C. | 若有3mol Fe2+ 参加反应,则被Fe2+还原的O2为1mol | |
| D. | 若有2mol Fe2+ 被氧化,则被Fe2+还原的O2为0.5mol |
2.下列离子方程式中,不正确的是( )
| A. | 等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-完全沉淀:2Ba2++4OH-+Al3++2SO42-═2BaBO4↓+AlO2-+2H2O | |
| C. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO-3+4OH-═Mg(OH)2↓+2CO32-+2H2O | |
| D. | 向Fe(NO3)2溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
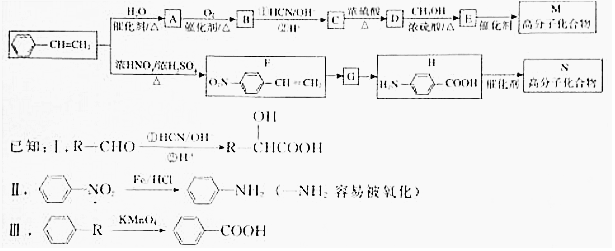
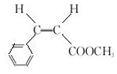 .
. 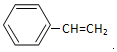 →F的反应类型为取代 反应.
→F的反应类型为取代 反应.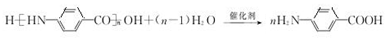 .
.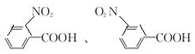 .
.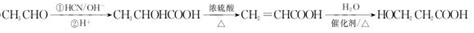 .
.