题目内容
10.写出下列物质的电离方程式:KOHKOH═K++OH-
CuCl2CuCl2=Cu2++2Cl-
Fe2(SO4)3Fe2(SO4)3=2Fe3++3SO42-
Na2SNa2S=2Na++S2-.
分析 氢氧化钾属于强电解质,能完全电离为钾离子和氢氧根;
氯化铜为强电解质,能完全电离为铜离子和氯离子;
硫酸铁为强电解质,能完全电离为铁离子和硫酸根;
硫化钠为强电解质,能完全电离为钠离子和硫离子.
解答 解:溶液中电离出氢氧根离子和钾离子,电离方程式为:KOH═K++OH-;
氯化铜为强电解质,能完全电离为铜离子和氯离子,故电离方程式为:CuCl2=Cu2++2Cl-;
硫酸铁为强电解质,能完全电离为铁离子和硫酸根,电离方程式:Fe2(SO4)3=2Fe3++3SO42-;
硫化钠为强电解质,能完全电离为钠离子和硫离子,电离方程式为:Na2S=2Na++S2-;
故答案为:KOH═K++OH-;CuCl2=Cu2++2Cl-;Fe2(SO4)3=2Fe3++3SO42-;Na2S=2Na++S2-;
点评 本题考查了电解质电离方程式的书写,应注意的是书写电离方程式时应注意强弱电解质的区别,难度不大.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
1.下列说法正确的是( )
| A. | 按系统命名法,化合物 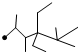 的名称是 2,3,5,5-四甲基-4,4-二乙基己烷 的名称是 2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等 | |
| C. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| D. | 结构片段为 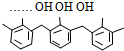 …的高聚物,其单体是甲醛和苯酚 …的高聚物,其单体是甲醛和苯酚 |
18.下列说法正确的是( )
| A. | 6.02×1023 就是阿佛加德罗常数 | |
| B. | 1 摩尔氢气含有2NA个氢原子 | |
| C. | 1 摩尔任何物质都含有6.02×1023 个分子 | |
| D. | 1 摩尔水含有18×6.02×1023 个分子 |
15.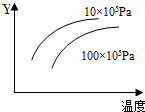 由可逆反应测绘出图象如下,纵坐标Y为生成物在平衡混合物中的体积百分含量,下列对该反应的判断正确的是( )
由可逆反应测绘出图象如下,纵坐标Y为生成物在平衡混合物中的体积百分含量,下列对该反应的判断正确的是( )
 由可逆反应测绘出图象如下,纵坐标Y为生成物在平衡混合物中的体积百分含量,下列对该反应的判断正确的是( )
由可逆反应测绘出图象如下,纵坐标Y为生成物在平衡混合物中的体积百分含量,下列对该反应的判断正确的是( )| A. | 正反应为一定为放热反应 | B. | 逆反应为体积缩小的反应 | ||
| C. | 升高温度,平衡常数K值减小 | D. | 该反应在一定条件下可自发进行 |
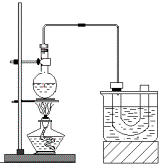 实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
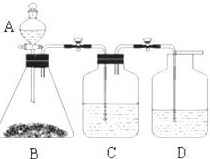 为了确定醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱,有人设计了如图所示的装置进行实验:
为了确定醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱,有人设计了如图所示的装置进行实验: