题目内容
15.除去下列物质中所含的少量杂质(括号中的物质)所选用的试剂和装置均正确的是( )Ⅰ.试剂:①KMnO4/H+②NaOH溶液 ③饱和Na2CO3溶液 ④H2O ⑤生石灰 ⑥浓溴水
Ⅱ:装置:
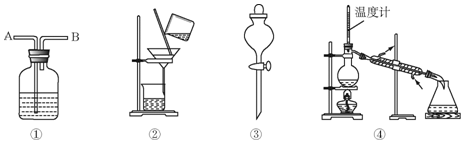
| 选项 | 物质 | 试剂 | 装置 |
| A | C2H6(C2H4) | ① | ① |
| B | 苯(苯酚) | ⑥ | ② |
| C | 苯(苯甲酸) | ⑤ | ④ |
| D | 甲苯(二甲苯) | ③ | ③ |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙烯被高锰酸钾氧化生成二氧化碳;
B.苯与苯酚互溶,可加NaOH反应后分液分离;
C.苯甲酸与CaO反应后,增大与苯的沸点差异;
D.甲苯、二甲苯互溶,但沸点不同.
解答 解:A.乙烯被高锰酸钾氧化生成二氧化碳,不能除杂,试剂不合理,故A不选;
B.苯与苯酚互溶,可加NaOH反应后分液分离,选溴水除杂时引入新杂质,试剂不合理,故B不选;
C.苯甲酸与CaO反应后,增大与苯的沸点差异,然后蒸馏可分离,则试剂、装置均合理,故C选;
D.甲苯、二甲苯互溶,但沸点不同,则试剂、装置不合理,应选蒸馏装置,故D不选;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握有机物的性质、混合物分离提纯方法为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
相关题目
5.标准状况下有如下气体:
①6.72L CH4 ②3.01×1023个HCl分子
③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系排列的组合中正确的是( )
a.体积:②>③b.密度:④>①c.质量:③>①d.氢原子个数:①>②
①6.72L CH4 ②3.01×1023个HCl分子
③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系排列的组合中正确的是( )
a.体积:②>③b.密度:④>①c.质量:③>①d.氢原子个数:①>②
| A. | abc | B. | bcd | C. | abd | D. | abcd |
6.下列说法中正确的是( )
| A. | 3s2表示3s能级有两个轨道 | |
| B. | 处于最低能量的原子叫做基态原子 | |
| C. | 同一原子中,1s、2s、3s电子的能量逐渐减小 | |
| D. | 同一原子中,3d、4d、5d能级的轨道数依次增多 |
3.分析能量变化示意图,确定下列热化学方程式书写正确的是( )
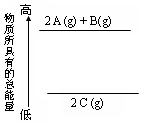

| A. | 2A+B=2C;△H<0 | B. | 2C(g)=2 A(g)+B(g);△H<0 | ||
| C. | 2A(g)+B(g)=2 C(g);△H>0 | D. | 2A(g)+B(g)=2 C(g);△H<0 |
10.硫酸工业尾气中的二氧化硫可用Na2SO3溶液吸收,将吸收液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中正确的是( )
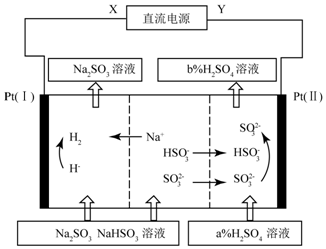

| A. | X为直流电源的正极,Y为直流电流的负极 | |
| B. | 图中的b<a | |
| C. | P(I)附近溶液的pH减小,Pt(II)附近溶液的pH增大 | |
| D. | 再生机理为:Pt(I)H+放电,导致“HSO3-?SO2-+H+”平衡右移 |
7.锌电池可代替铅蓄电池,它的构成材料是锌、空气、某种电解质溶液,发生的总反应是2Zn+O2═2ZnO.下列有关它的说法不正确的是( )
| A. | 锌为电池负极,发生氧化反应 | |
| B. | 电池工作时,氧气与锌直接化合,生成氧化锌 | |
| C. | 正极发生的反应是:$\frac{1}{2}$O2+2e-+2H+═H2O | |
| D. | 负极发生的反应是:Zn-2e-+H2O═ZnO+2H+ |
5.将铁粉和铜粉的均匀混合物,平均分为四等分,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量表如表(设硝酸的还原产物只有NO)
试计算:
(1)硝酸的浓度.
(2)每份金属混合物的总质量.
(3)实验④中V的值.
| 编号 | ① | ② | ③ | ④ |
| 稀硝酸体积/ml | 100mL | 200mL | 300mL | 400mL |
| 剩余金属/g | 18.0g | 9.6g | 0 | 0 |
| NO体积/L | 2.24L | 4.48L | 6.7L | V |
(1)硝酸的浓度.
(2)每份金属混合物的总质量.
(3)实验④中V的值.
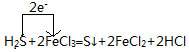 .
.