题目内容
下列电离方程式中,正确的是( )
| A、Na2SO4═2Na++SO42- |
| B、Ba(OH)2═Ba+2+2OH- |
| C、Al2(SO4)3═2Al3++3SO42- |
| D、Ca(NO3)2═Ca2++2(NO3)2- |
考点:电离方程式的书写
专题:离子反应专题
分析:A.硫酸钠为强电解质,溶液中完全电离出钠离子和硫酸根离子;
B.钡离子的书写不规范,正确表示应该为:Ba2+;
C.铝离子带有3个单位正电荷,铝离子表示方法错误,正确表示应该为:Al3+;
D.硝酸根离子带有1个单位负电荷,硝酸根离子表示方法错误.
B.钡离子的书写不规范,正确表示应该为:Ba2+;
C.铝离子带有3个单位正电荷,铝离子表示方法错误,正确表示应该为:Al3+;
D.硝酸根离子带有1个单位负电荷,硝酸根离子表示方法错误.
解答:
解:A.硫酸钠在溶液中完全电离出钠离子和硫酸根离子,其电离方程式为:Na2SO4═2Na++SO42-,故A正确;
B.氢氧化钡在溶液中完全电离出钡离子、氢氧根离子,钡离子书写错误,正确的电离方程式为:Ba(OH)2═Ba2++2OH-,故B错误;
C.硫酸铝在溶液中电离出铝离子、硫酸根离子,铝离子书写错误,正确的电离方程式为:Al2(SO4)3═2Al3++3SO42-,故C错误;
D.硝酸钙在溶液中完全电离出钙离子、硝酸根离子,硝酸根离子书写错误,正确的电离方程式为:Ca(NO3)2═Ca2++2NO3-,故D错误;
故选A.
B.氢氧化钡在溶液中完全电离出钡离子、氢氧根离子,钡离子书写错误,正确的电离方程式为:Ba(OH)2═Ba2++2OH-,故B错误;
C.硫酸铝在溶液中电离出铝离子、硫酸根离子,铝离子书写错误,正确的电离方程式为:Al2(SO4)3═2Al3++3SO42-,故C错误;
D.硝酸钙在溶液中完全电离出钙离子、硝酸根离子,硝酸根离子书写错误,正确的电离方程式为:Ca(NO3)2═Ca2++2NO3-,故D错误;
故选A.
点评:本题考查了电离方程式的书写判断,题目难度不大,注意掌握强弱电解质的判断方法,明确电离方程式的书写原则,试题有利于提高学生灵活应用所学知识的能力.

练习册系列答案
相关题目
人体正常血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化为Fe3+而中毒,服用维生素C可以解毒.对上述事实分析不正确的是( )
| A、亚硝酸盐是氧化剂 |
| B、维生素C是氧化剂 |
| C、亚硝酸盐将Fe3+还原成Fe2+ |
| D、维生素C被Fe3+氧化 |
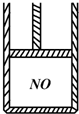 如图为装有活塞(质量忽略不计)的密闭容器,内盛22.4mL一氧化氮,若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度压强不变,则容器内的密度为(提示:不考虑NO转化为NO2的可逆性)( )
如图为装有活塞(质量忽略不计)的密闭容器,内盛22.4mL一氧化氮,若通入11.2mL氧气(气体体积均在标准状况下测定),保持温度压强不变,则容器内的密度为(提示:不考虑NO转化为NO2的可逆性)( )| A、等于1.369g?L-1 |
| B、等于2.054g?L-1 |
| C、在1.369g?L-1和2.054g?L-1之间 |
| D、在2.054g?L-1和4.108g?L-1之间 |
下列能达到实验目的是( )
A、 除去Fe(OH)3胶体中的FeCl3 |
B、 干燥、收集氨气,并吸收多余的氨气 |
C、 分离乙醇、乙酸 |
D、 除去杂质气体二氧化碳 |
下列实验操作正确的是( )
A、 蒸馏乙醇溶液 |
B、 将乙醇与水分分离 |
C、 铁丝在纯氧中燃烧 |
D、 排空法收集CO2 |
中学化学教材中,常借助于图象的这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理.下列有关化学图象表现的内容正确的是( )
A、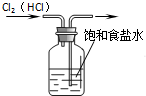 除去Cl2中的HCl杂质 |
B、 稀释浓H2S04 |
C、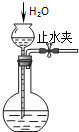 检查装置气密性 |
D、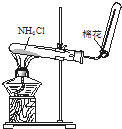 实验室制取NH3 |
下列叙述正确的是( )
| A、1H和3H的质子数相同,它们是同种核素 |
| B、6Li和7Li的质子数相等,电子数也相等 |
| C、14C和14N的质量数相等,它们的中子数相等 |
| D、13C和14C属于同一种元素,它们的质量数相等 |