题目内容
中学化学教材中,常借助于图象的这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理.下列有关化学图象表现的内容正确的是( )
A、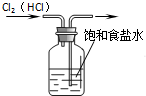 除去Cl2中的HCl杂质 |
B、 稀释浓H2S04 |
C、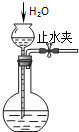 检查装置气密性 |
D、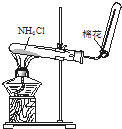 实验室制取NH3 |
考点:化学实验方案的评价
专题:实验评价题
分析:A.除杂的进气应长进短出;
B.不能在量筒中进行稀释操作;
C.关闭止水夹,利用长颈漏斗中导管内液柱高度检验气密性;
D.氯化铵分解生成氨气和HCl,在试管口氨气、HCl又化合生成氯化铵.
B.不能在量筒中进行稀释操作;
C.关闭止水夹,利用长颈漏斗中导管内液柱高度检验气密性;
D.氯化铵分解生成氨气和HCl,在试管口氨气、HCl又化合生成氯化铵.
解答:
解:A.除杂的进气应长进短出,图中气体的进气方向不合理,故A错误;
B.不能在量筒中进行稀释操作,应在烧杯中溶解,故B错误;
C.关闭止水夹,利用长颈漏斗中导管内液柱高度检验气密性,若一段时间内高度不变,则气密性良好,图中装置合理,故C正确;
D.氯化铵分解生成氨气和HCl,在试管口氨气、HCl又化合生成氯化铵,则不能制备氨气,应利用铵盐与碱共热制备氨气,故D错误;
故选C.
B.不能在量筒中进行稀释操作,应在烧杯中溶解,故B错误;
C.关闭止水夹,利用长颈漏斗中导管内液柱高度检验气密性,若一段时间内高度不变,则气密性良好,图中装置合理,故C正确;
D.氯化铵分解生成氨气和HCl,在试管口氨气、HCl又化合生成氯化铵,则不能制备氨气,应利用铵盐与碱共热制备氨气,故D错误;
故选C.
点评:本题考查化学实验方案的评价,为高频考点,涉及除杂、稀释、气密性检查及氨气的制备等,把握实验基本操作及实验技能为解答的关键,侧重实验基本技能的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
在强碱性溶液中能大量共存,并且溶液为无色透明的离子组是( )
A、NH
| ||||||
| B、K+、Na+、[Al(OH)4]-、NO3- | ||||||
C、K+、NH
| ||||||
D、Na+、K+、NO
|
下列电离方程式中,正确的是( )
| A、Na2SO4═2Na++SO42- |
| B、Ba(OH)2═Ba+2+2OH- |
| C、Al2(SO4)3═2Al3++3SO42- |
| D、Ca(NO3)2═Ca2++2(NO3)2- |
下列基本实验操作正确的是( )
| A、.稀释浓硫酸时将水沿器壁缓慢注入浓硫酸中,同时不断搅拌 |
| B、.过滤时,滤纸的边缘要高于漏斗的边缘 |
| C、.胶头滴管的尖嘴部分直接伸入试管里滴加液体 |
| D、实验室取用液体药品做性质实验时,如果没有说明用量,一般取1~2mL |
下列有关实验现象与其它三项不同的是( )
| A、向BaCl2溶液中通入少量CO2 |
| B、向饱和Na2CO3溶液中通CO2 |
| C、向Ba(OH)2溶液中滴加K2SO4溶液 |
| D、向Ca(OH)2溶液中通入少量CO2 |
某反应的反应物浓度在5min内由6mol/L 变成了2mol/L,则以该反应物浓度的变化表示的该反应在这段时间内的平均反应速率为( )
| A、4 mol/L |
| B、4 mol/(L?min) |
| C、0.8 mol/L |
| D、0.8 mol/(L?min) |
下列有关金属的说法正确的是( )
| A、金属原子只有还原性,金属阳离子只有氧化性 |
| B、金属单质在常温下都是固体 |
| C、金属阳离子被还原不一定得到金属单质 |
| D、含金属元素的离子都是阳离子 |
 如图为实验室某浓硫酸酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓硫酸酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: