题目内容
下列说法中正确的是( )
| A、△H的大小与热化学方程式的化学计量数无关 |
| B、生成物的总焓大于反应物的总焓时,反应吸热,△H>0 |
| C、在化学反应过程中,发生物质变化的同时不一定发生能量变化 |
| D、破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,该反应为吸热反应 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A.焓变和物质的量有关,计量数改变,反应的焓变改变;
B.△H=生成物能量和-反应物能量和;
C.任何化学反应一定有能量变化;
D.△H=断裂化学键的能量和-成键的能量和.
B.△H=生成物能量和-反应物能量和;
C.任何化学反应一定有能量变化;
D.△H=断裂化学键的能量和-成键的能量和.
解答:
解:A.焓变和物质的量和物质聚集状态有关,计量数改变,反应的焓变改变,故A错误;
B.△H=生成物能量和-反应物能量和,所以当生成物的总焓大于反应物的总焓时,反应吸热,△H>0,故B正确;
C.化学反应的过程就是旧键断裂和新键形成的过程,断键和成键都有能量变化,所以说任何化学反应都一定有能量变化,故C错误;
D..△H=反应物中断裂化学键的能量和-生成物中断裂化学键的能量和,△H<0为放热反应,则破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为放热反应,故D错误;
故选:B.
B.△H=生成物能量和-反应物能量和,所以当生成物的总焓大于反应物的总焓时,反应吸热,△H>0,故B正确;
C.化学反应的过程就是旧键断裂和新键形成的过程,断键和成键都有能量变化,所以说任何化学反应都一定有能量变化,故C错误;
D..△H=反应物中断裂化学键的能量和-生成物中断裂化学键的能量和,△H<0为放热反应,则破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为放热反应,故D错误;
故选:B.
点评:本题考查反应焓变与反应的吸、放热关系,把握常见反应中的能量变化为解答的关键,注意焓变的计算方法.

练习册系列答案
相关题目
下列各选项中所述的两个量,前者一定大于后者的是( )
| A、1 L 0.3 mol?L-1 CH3COOH和3 L 0.1 mol?L-1 CH3COOH中的H+数目 |
| B、1 L 0.3 mol?L-1 CH3COOH和3 L 0.1 mol?L-1 CH3COOH的电离常数 |
| C、在4NH3+6NO═5N2+6H2O反应中,被氧化和被还原的N原子数 |
| D、纯水在25℃和80℃时的pH |
长期吸食或注射毒品会危及人体健康,下列各组中都属于毒品的是( )
| A、冰毒、黄连素 |
| B、海洛因、阿司匹林 |
| C、大麻、摇头丸 |
| D、尼古丁、青霉素 |
分子式为C4H10O的有机物有多种同分异构体,其中属于醇的同分异构体共有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
下列叙述中正确的是( )
| A、含氧酸具有氧化性,无氧酸则不具有氧化性 |
| B、阳离子只有氧化性,阴离子只有还原性 |
| C、失电子难的原子获得电子的能力一定强 |
| D、由X变为X2+的反应是氧化反应 |
下列有关分子的结构和性质的说法中正确的是( )
| A、PCl3和SO2都是极性分子 |
| B、H2O是一种非常稳定的化合物,这是由于氢键所致 |
| C、BF3、NCl3分子中所有原子的最外层电子都满足8电子稳定结构 |
| D、凡是中心原子采取sp3杂化轨道形成的分子其几何构型都是正四面体 |
下列各组物质中,按酸、碱、盐的顺序排列正确的是( )
| A、氢硫酸、烧碱、明矾 |
| B、硫酸、纯碱、石膏 |
| C、硝酸、乙醇、醋酸钠 |
| D、磷酸、熟石灰、苛性钠 |
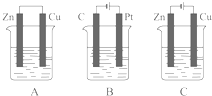 如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.
如图所示,A、B、C三个装置的烧杯中分别盛有足量的CuCl2溶液.