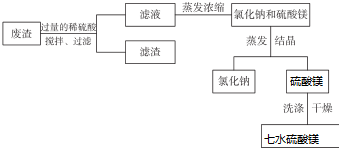
题目内容
13. 以乙烯为原料,可以制备乙酸乙酯
以乙烯为原料,可以制备乙酸乙酯乙烯$\stackrel{①}{→}$乙醇$\stackrel{②}{→}$乙酸$\stackrel{③}{→}$乙酸乙酯
(1)③的反应类型是酯化反应;
(2)乙醇分子中官能团的名称是羟基;
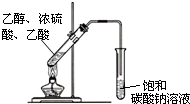
(3)利用图示装置制取乙酸乙酯.写出生成乙酸乙酯的化学方程式:CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;
(4)实验操作中,为了加快反应速率,采取的措施是加热、加入浓硫酸;出于对实验安全的考虑,采取的措施是浓硫酸在乙醇之后加入;在左边的试管中加入沸石;导管口不能插入饱和碳酸钠溶液中.(上述措施各举两个例子即可)
分析 用乙烯为原料制备乙酸乙酯时,先用乙烯和水发生加成反应制备乙醇,然后用乙醇氧化后生成乙酸,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,实验时注意药品加入顺序,防止酸液飞溅以及溶液的暴沸,用饱和碳酸钠溶液吸收,并注意防止倒吸,以此解答该题.
解答 解:(1)乙酸与乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯,故答案为:酯化反应;
(2)乙醇分子式为CH3CH2OH,是乙基和羟基连接形成的,官能团名称为羟基,故答案为:羟基;
(3)成乙酸乙酯的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,
故答案为:CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;
(4)化学反应温度高,反应快,酯化反应是可逆过程,乙酸与乙醇反应,浓硫酸吸水有利于平衡向生成乙酸乙酯方向移动,提高原料利用率;浓硫酸溶于水放出大量的热,加入药品时,为防止酸液飞溅,应先加入乙醇再加入浓硫酸和乙酸,液体乙酸乙醇沸点低,加热要加碎瓷片,防止暴沸;导管不能插入溶液中,导管要插在饱和碳酸钠溶液的液面上,伸入液面下可能发生倒吸,
故答案为:加热、加入浓硫酸;浓硫酸在乙醇之后加入;在左边的试管中加入沸石;导管口不能插入饱和碳酸钠溶液中.
点评 本题考查有机物合成、制备,为高频考点,侧重于学生的分析能力的考查,涉及烯烃、醇、醛、羧酸、酯之间的转化,明确官能团及其性质关系即可解答,注意反应条件,题目难度不大.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
17.25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是( )
| A. | 在0.1 mol•L-1Na2S溶液中:2c(Na+)>c(S2-)>c(HS-)>c(OH-) | |
| B. | 一定量的(NH4)2SO4与NH3•H2O混合所得的酸性溶液中:c(NH4+)<2c(SO42-) | |
| C. | 将0.1 mol•L-1盐酸与0.1 mol•L-1K2CO3溶液等体积混合:c(K+)>c(Cl-)>c(OH-)>c(HCO3-)>c(H+) | |
| D. | 将0.1 mol•L-1Na2CO3溶液和0.1 mol•L-1NaHCO3溶液等体积混合:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
1.硅孔雀石是一种含铜的矿石,含铜形态为CuCO3•Cu(OH)2和CuSiO3•2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质.以硅孔雀石为原料制取硫酸铜的工艺流程如图:
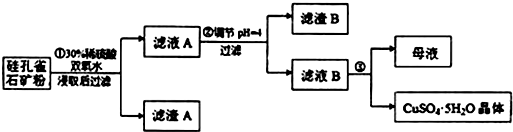
请回答下列问题:
(1)完成步骤①中稀硫酸与CuSiO3•2H2O发生反应的化学方程式
CuSiO3•2H2O+H2SO4═CuSO4+H4SiO4+H2O;
用离子方程式表示双氧水的作用2Fe2++H2O2+2H+═2Fe3++2H2O.
(2)步骤②调节溶液pH选用的最佳试剂是B
A.Fe2O3 B.CuO C.Al2O3 D.NH3•H2O
(3)有关氢氧化物开始沉淀和完全沉淀的pH如表:
由上表可知:当溶液pH=4时,可以完全除去的离子是Fe3+,不能完全除去的离子是Al3+.
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4•5H2O晶体.某同学认为上述操作会拌有硫酸铝晶体的析出.请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中c(Al3+)=2.25mol•L-1,Ksp[Al(OH)3]=3.2×10-34)该同学的观点是错误的;通过计算可知,滤液B中,c(Al3+)=3.2×10-4mol/L,浓缩后c(Al3+)=6.4×10-4mol/L<<2.25mol/L,所以不会有硫酸铝晶体析出.

请回答下列问题:
(1)完成步骤①中稀硫酸与CuSiO3•2H2O发生反应的化学方程式
CuSiO3•2H2O+H2SO4═CuSO4+H4SiO4+H2O;
用离子方程式表示双氧水的作用2Fe2++H2O2+2H+═2Fe3++2H2O.
(2)步骤②调节溶液pH选用的最佳试剂是B
A.Fe2O3 B.CuO C.Al2O3 D.NH3•H2O
(3)有关氢氧化物开始沉淀和完全沉淀的pH如表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4•5H2O晶体.某同学认为上述操作会拌有硫酸铝晶体的析出.请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3饱和溶液中c(Al3+)=2.25mol•L-1,Ksp[Al(OH)3]=3.2×10-34)该同学的观点是错误的;通过计算可知,滤液B中,c(Al3+)=3.2×10-4mol/L,浓缩后c(Al3+)=6.4×10-4mol/L<<2.25mol/L,所以不会有硫酸铝晶体析出.
18.下列说法不正确的是( )
| A. | 铁在潮湿空气中生锈是自发过程 | B. | 有些放热反应常温下是非自发的 | ||
| C. | 自发反应都是熵增大的反应 | D. | 电解池的反应不都是非自发反应 |
5.N2O4(无色)?2NO2(红综色),其能量变化示意图如下,则关于该反应的说法正确的是( )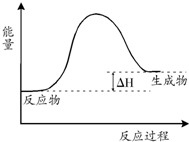

| A. | 该反应是吸热反应 | |
| B. | 当反应达到平衡时,升高温度,混合气体的颜色变浅 | |
| C. | 反应体系中加入催化剂对反应热是有影响 | |
| D. | 在反应体系中加入催化剂,正反应速率增大,逆反应速率减小 |
2.实验室里需要配制480mL0.1mol/L的硫酸铜溶液,下列实验用品及实验操作都正确的是( )
| 选项 | 容量瓶的容积 | 固体质量 | 实验操作 |
| A | 480mL | 硫酸铜:7.7g | 加入500mL水 |
| B | 480mL | 胆矾:12.0g | 配成500mL溶液 |
| C | 500mL | 硫酸铜:8.0g | 加入500mL水 |
| D | 500mL | 胆矾:12.5g | 配成500mL溶液 |
| A. | A | B. | B | C. | C | D. | D |