题目内容
10.运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.(1)合成氨反应N2(g)+3H2(g)?2NH3(g),若在恒温恒压条件下向平衡体系中通入氩气,平衡向左(填“向左”“向右”或“不”)移动;使用催化剂,反应的△H不改变(填“增大”“减小”或“不改变”).
(2)在25℃下,将a mol/L的氨水与0.01mol/L的盐酸等体积混合,反应达到平衡时溶液中c(NH4+)>c(Cl-),则溶液显碱性(填“酸”“碱”或“中”).
(3)在25℃下,向浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀(填化学式),生成该沉淀的离子方程式为Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+.已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20.
(4)有人设想寻求合适的催化剂和电极材料,以N2和H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池.则正极附近的pH增大(填“增大”“减小”或“不变”);负极的电极反应方程式为H2-2e-═2H+.
分析 (1)恒温恒压条件下向平衡体系中通入氩气,体积增大,等效为降低压强,平衡向体积增大的方向移动;
反应热只与始态与状态有关,催化剂改变平衡建立的途径,不影响始态与终态,反应热不变;
(2)根据电荷守恒判断铵根离子浓度和氯离子浓度相对大小;
(3)Mg(OH)2、Cu(OH)2的结构类型相同,溶度积越小,溶解度越小,加入相同的浓度的氨水,最先析出;
(4)原电池的正极上发生得电子的还原反应,负极发生失电子的氧化反应,据此分析.
解答 解:(1)恒温恒压条件下向平衡体系中通入氩气,体积增大,等效为降低压强,平衡向体积增大的方向移动,该反应正反应是体积减小的反应,故平衡向左移动.
反应热只与始态与状态有关,催化剂改变平衡建立的途径,不影响始态与终态,反应热不变,
故答案为:向左;不改变;
(2)溶液中存在电荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)>c(Cl-),故c(H+)<c(OH-),溶液呈碱性,故答案为:碱;
(3)Mg(OH)2、Cu(OH)2的结构类型相同,Cu(OH)2溶度积更小,溶解度越小,加入相同的浓度的氨水,Cu(OH)2最先析出,反应离子方程式为:Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+;
故答案为:Cu(OH)2;Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+;
(4)正极上氮气得电子和氢离子反应生成铵根离子,即电极反应为N2+8H++6e-═2NH4+,所以正极附近的pH增大,负极为氢气失电子发生氧化反应,反应式为:H2-2e-═2H+;故答案为:增大;H2-2e-═2H+.
点评 本题考查化学平衡影响因素、离子浓度比较、难溶电解质的沉淀问题、燃料电池的工作原理和规律知识,比较综合,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(1)反应C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量 B.升高温度 C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则反应 CO(g)+H2O(g)?CO2(g)+H2(g) 的△H=-41.2kJ•mol-1.
(3)在298k温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如表数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②若反应在398K进行,某时刻测得n(CO)=0.5mol n(H2O)=1.0mol,n(CO2)=1.0mol n(H2)=1.2mol则此时V(正)<V(逆)(填“>”、“<”或“=”).
(4)CaS在一定条件下经原子利用率100%的高温反应生成CaSO4,该反应的化学方程式为CaS+2O2$\frac{\underline{\;高温\;}}{\;}$CaSO4;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,对二甲苯的结构产简式为:
 ,产物的结构简式为
,产物的结构简式为 .
. 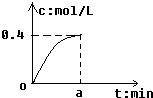 反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )
反应2SO2+O2?2SO3经amin后,SO3浓度的变化情况如图所示,在时间0-amin内用O2表示的平均反应速率为0.04mol/(L•min),则a等于( )| A. | 0.1 | B. | 2.5 | C. | 5 | D. | 10 |
| A. | 130ml | B. | 100ml | C. | 90ml | D. | 50ml |
| A. | Y的价层电子排布式为3s23p5 | |
| B. | 稳定性:Y的氢化物>Z的氢化物 | |
| C. | 第一电离能:Y<Z | |
| D. | X、Y两元素形成的化合物为离子化合物 |
 有可逆反应mA(s)+nB(g)═pC(g)+qD(g),反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图所示,根据图中曲线分析,判断下列叙述中,正确的是( )
有可逆反应mA(s)+nB(g)═pC(g)+qD(g),反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图所示,根据图中曲线分析,判断下列叙述中,正确的是( )| A. | 到达平衡后,若使用催化剂,C的质量分数增大 | |
| B. | 平衡后,若升高温度,平衡则向逆反应方向移动 | |
| C. | 平衡后增大A的量,有利于提高A的转化率 | |
| D. | 化学方程式中一定是m+n<p+q |