题目内容
4.化学反应原理在科研和生产中有广泛应用.(1)SO2可用于制硫酸.已知25℃、101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol;
①已知:H2O(g)═H2O(l)△H=-44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H=-545kJ/mol.
则SO3(g)与H2O(l)反应的热化学方程式是SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ/mol.
②对于反应2SO2(g)+O2(g)?2SO3(g),在压强为P1时,混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态).若温度为T1时,反应进行到状态B时,V正>V逆(填“>”“<”或“=”).在图1中画出压强为P2(P2>P1)时SO3的百分含量随温度的变化曲线图.
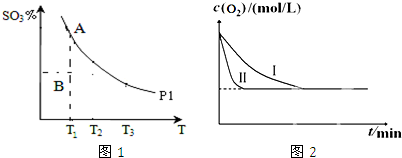
③实验室模拟化工生产,在恒容密闭容器中冲入一定量SO2和O2后,分别在不同实验条件下反应,O2浓度随时间变化如图2.与实验Ⅰ比较,实验Ⅱ改变的条件为加入催化剂.
(2)一定条件下,溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示.
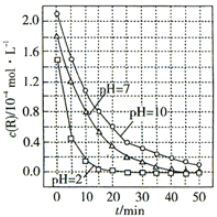
①在20-25min之间,pH=10时R的平均降解速率4×10-6mol•L-1•min-1.
②从图中可以读出,溶液的酸性与降解速率的关系是:溶液的酸性越强,R的降解速率越大.
(3)已知反应:TaS2(s)+2I2(g)?TaI4(g)+S2(g)△H>0;
某温度下,该反应的平衡常数K=1,向某恒容容器中加入1mol I2 (g)和足量TaS2(s),I2 (g)的平衡转化率为67%(保留两位有效数字).
分析 (1)①利用盖斯定律,将热化学方程式进行运算,(③-①+②)×$\frac{1}{2}$计算反应的焓变,得到SO3 (g)与H2O(l)反应的热化学方程式;
②B状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行;反应2SO2(g)+O2(g)?2SO3(g)是气态体积减小的反应,P2>P1 ,增大压强,平衡正向进行相同温度下三氧化硫百分含量增大,据此画出图象;
③与实验Ⅰ比较,实验Ⅱ达到平衡时间少,说明反应速率增大,但平衡不移动,应加入催化剂;
(2)①根据平均降解速率v=$\frac{△c}{△t}$进行计算;
②对比溶液的酸性强弱对R的降解速率的影响进行判断;
(3)通过题意求出平衡浓度,带入K值可以得出转化率.
解答 解:(1)①2SO2(g)+O2(g)=2SO3(g)△H1=一197kJ/mol ①
2H2O (g)=2H2O(1)△H2=-44kJ/mol ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol③
利用盖斯定律:(③-①+②)×$\frac{1}{2}$得SO3 (g)+H2O(l)=H2SO4(l)△H=-130kJ/mol,
故答案为:SO3(g)+H2O(l)=H2SO4(l)△H=-130kJ/mol;
②B状态未达平衡,混合体系中SO3的百分含量小于平衡时的,反应向正反应进行,所以V正>V逆,反应2SO2(g)+O2(g)?2SO3(g)是气态体积减小的反应,P2>P1 ,增大压强,平衡正向进行相同温度下三氧化硫百分含量增大,画出的图象为: ,
,
故答案为:>; ;
;
③与实验Ⅰ比较,实验Ⅱ达到平衡时间少,说明反应速率增大,但平衡不移动,应加入催化剂,而压强、温度都可使平衡移动,
故答案为:使用催化剂;
(2)①在20-25min之间,pH=10时R的平均降解速率为$\frac{0.6-0.4}{5}$×10-4=4×10-6mol•L-1•min-1,
故答案为:4×10-6mol•L-1•min-1;
②溶液酸性越强,即pH越小,线的斜率越大,可以知道R的降解速率越大,
故答案为:溶液酸性越强,R的降解速率越大;
(3)K=1,设 I2的平衡转化率为x,则参加反应的为xmol,平衡时生成TaI4和S2各0.5xmol,剩余I2为(1-x)mol,
根据K=$\frac{c(Ta{I}_{4})c({S}_{2})}{{c}^{2}({I}_{2})}$=$\frac{0.5x×0.5x}{(1-x)^{2}}$=1,
解之得:x=67,
故答案为:67%.
点评 本题考查化学平衡的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,题目涉及化学反应的吸放热于反应物产物能量之间的关系、热化学方程式和盖斯定律的计算等知识,难度中等.

 寒假学与练系列答案
寒假学与练系列答案(1)写出浓硫酸与木炭反应方程式,并标明电子转移的方向和数目:
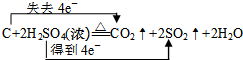 .
.【装置设计】组装如下的实验装置,然后进行实验探究.
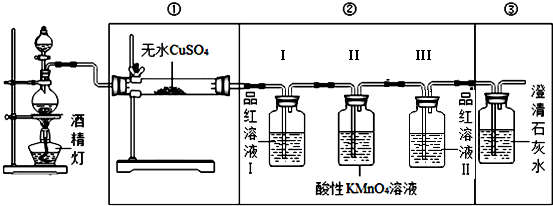
(2)装入反应物之前,必须先检验装置气密性.
【实验探究】
(3)观察实验,完成实验现象的部分记录:
| 实验装置 | ① | ③ |
| 实验现象 |
| 温度/°C | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的平衡常数表达式K=$\frac{c(C)c(D)}{c(A)c(B)}$,△H<0(填“<”“>”“=”);
(2)830°C时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol•L-1•s-1,则6s时c(A)=0.022mol•L-1,C的物质的量为0.09mol;若反应经一段时间后,达到平衡时A的转化率为80%
(3)判断该反应是否达到平衡的依据为c(填正确选项前的字母);
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200°C时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为2.5.

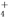 、Fe3+、Br-、CO
、Fe3+、Br-、CO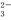 、I-、SO
、I-、SO