题目内容
3.元素周期表是学习物质结构与性质的重要工具.下表是元素周期表的一部分,表中所列字母A、B、D、E、G、H、Q、M、R分别代表某一化学元素.请用所给元素回答下列问题.(均用元素符号填写)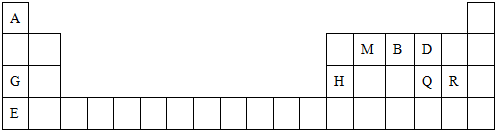
(1)被选作相对原子质量标准的核素是126C(填写核素符号),B元素在元素周期表中的位置第二周期第ⅤA族.
(2)E、Q、R三种元素原子形成的简单离子具有相同电子层结构,其中半径最大的离子的是S2-(填离子符号); 写出MD2分子的结构式:O=C=O.
(3)选取两种元素,形成既含有离子键又含有共价键的化合物,该化合物电子式为
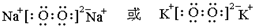 ;最高价氧化物的水化物中,酸性最强的化合物分子式为HClO4.
;最高价氧化物的水化物中,酸性最强的化合物分子式为HClO4.(4)用表中所给元素组成反应物,请各用一个化学方程式说明:
元素Q和R非金属性的强弱:Cl2+Na2S=2NaCl+S↓;
元素G和H的金属性强弱:NaOH+Al(OH)3=NaAlO2+2H2O.
分析 由元素在周期表中位置,可知A为氢,M为碳,B为氮,D为氧,G为Na,H为Al,Q为硫,R为Cl,E为钾.
(1)被选作相对原子质量标准的核素是质量数为12的碳原子;由元素位置可知,B处于周期表中第二周期第ⅤA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大;CO2分子中碳原子与氧原子之间形成2对共用电子对;
(3)形成既含有离子键又含有共价键的化合物为Na2O2等;最高价氧化物的水化物中酸性最强的是高氯酸;
(4)利用单质之间相互置换反应说明非金属性的强弱;利用最高价氧化物对应水化物的碱性强弱判断金属性强弱.
解答 解:由元素在周期表中位置,可知A为氢,M为碳,B为氮,D为氧,G为Na,H为Al,Q为硫,R为Cl,E为钾.
(1)被选作相对原子质量标准的核素是质量数为126C,由元素位置可知,B处于周期表中第二周期第ⅤA族,
故答案为:126C;第二周期第ⅤA族;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大,故离子半径:S2->Cl->Na+,CO2分子中碳原子与氧原子之间形成2对共用电子对,结构式为O=C=O,
故答案为:S2-;O=C=O;
(3)形成既含有离子键又含有共价键的化合物为Na2O2、K2O2,电子式为: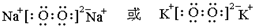 ,最高价氧化物的水化物中酸性最强的是HClO4,
,最高价氧化物的水化物中酸性最强的是HClO4,
故答案为: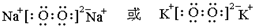 ;HClO4;
;HClO4;
(4)元素Q(Cl)和R(S)非金属性的强弱:Cl2+Na2S=2NaCl+S↓,
元素G(Na)和H(Al)的金属性强弱:NaOH+Al(OH)3=NaAlO2+2H2O,
故答案为:Cl2+Na2S=2NaCl+S↓;NaOH+Al(OH)3=NaAlO2+2H2O.
点评 本题考查元素周期表与元素周期律应用,熟练掌握元素周期表的结构,掌握金属性、非金属性强弱比较实验事实.

 名校课堂系列答案
名校课堂系列答案| A. | 煤中含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 石油裂解主要目的是得到短链的不饱和烃 | |
| D. | 煤的气化与液化都是化学变化 |
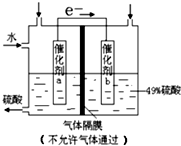
| A. | 该装置将化学能转化为电能,电流方向为b→a | |
| B. | 催化剂b表面O2发生还原反应,其附近酸性增强 | |
| C. | 催化剂a表面的反应:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8:15 |
| A. | 10gH218O与10gD2O所含的中子数均为5NA | |
| B. | 1L0.1mol•L-1NH4Cl溶液所含NH4+数为0.1NA | |
| C. | 2.4gMg在空气中充分燃烧,转移电子数为0.2NA | |
| D. | 100g质量分数为46%的酒精水溶液中含氧原子总数为4NA |
| A. | 20.625kJ | B. | 41.25kJ | C. | 82.5kJ | D. | 165.0kJ |
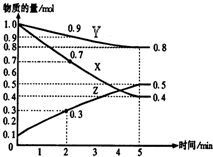 某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示.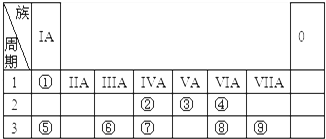
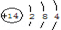 ;
;