题目内容
牛奶和奶粉中添加三聚氰胺冒充蛋白质,在社会上造成了很坏的影响.已知三聚氰胺中含有碳、氢、氮三种元素,其相对分子质量为126,为测定三聚氰胺的组成,用下列各仪器装置,在过量的氧气中将2.52g三聚氰胺样品氧化成CO2、H2O和N2.回答下列问题:
(1)产生的氧气按从左向右流向,所选装置的连接顺序为(不得重复)
D→ → → →F→

(2)装置F中CuO的作用是 装置D中发生反应的化学方程式是
(3)实验后称得A、B两装置的质量分别增加2.64g和1.08g,则三聚氰胺的分子式为
(4)按(1)的连接方法,此实验装置存在的缺陷是 .
(1)产生的氧气按从左向右流向,所选装置的连接顺序为(不得重复)
D→

(2)装置F中CuO的作用是
(3)实验后称得A、B两装置的质量分别增加2.64g和1.08g,则三聚氰胺的分子式为
(4)按(1)的连接方法,此实验装置存在的缺陷是
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据实验过程:在过量的氧气流中将2.52g三聚氰胺样品氧化成CO2、H2O和N2,二氧化碳的含量测定可以用碱石灰,一氧化碳含量测定用氧化铜,根据质量守恒可以计算有机物质中氮元素的含量;
(2)根据实验目的结合各个装置的作用来回答判断;
(3)根据元素守恒结合质量守恒计算原子数目,进而确定分子式,根据结构特点确定结构简式;
(4)根据实验过程中各种干扰实验结果的可能因素来回答,空气中的二氧化碳和水蒸气影响测定结果.
(2)根据实验目的结合各个装置的作用来回答判断;
(3)根据元素守恒结合质量守恒计算原子数目,进而确定分子式,根据结构特点确定结构简式;
(4)根据实验过程中各种干扰实验结果的可能因素来回答,空气中的二氧化碳和水蒸气影响测定结果.
解答:
解:(1)在过量的氧气流中将2.52g三聚氰胺样品氧化成CO2、H2O和N2,制取的氧气必须要用浓硫酸来干燥,所以开始连接顺序是DCE,一氧化碳含量测定用氧化铜,但是一氧化碳的检验必须在前,在测定一氧化碳的含量之前要用无水氯化钙对气体进行干燥,可以用A装置测定二氧化碳的量,并且放在最后来检测,产生的氧气按从左向右流向DCEBFA;
故答案为:C;E;B;A;
(2)装置C的作用是:吸收O2中的水蒸气,防止对实验数据造成影响,有机物燃烧产物含有一氧化碳,装置F中CuO的作用是用氧化铜可以氧化没有燃烧完全的CO,装置D中发生反应是过氧化氢在二氧化锰催化作用下分解生成水和氧气,反应的化学方程式2H2O2
2H2O+O2↑;
故答案为:氧化没有燃烧完全的CO;2H2O2
2H2O+O2↑;
(3)三聚氰胺中含有碳、氢、氮三种元素,其相对分子质量为126,2.52g即0.02mol三聚氰胺样品氧化成CO2、H2O和N2,A、B两装置分别测定的是二氧化碳、水的质量,所以二氧化碳质量是2.64g,所以碳原子数目是3,即0.06mol,水的质量是1.08g,即0.06mol,所以氢原子个数是6,根据分子相对分子质量式126,所以氮原子数是3,即分子式为C3H6N6,故答案为:C3H6N6;
(4)为了保证测得二氧化碳中的碳元素全部来自有机物,所以要避开空气中二氧化碳的干扰,还缺少尾部缺少一个干燥装置,
故答案为:尾部缺少一个干燥装置,空气中的水蒸气和CO2进入A装置,影响CO2测定值.
故答案为:C;E;B;A;
(2)装置C的作用是:吸收O2中的水蒸气,防止对实验数据造成影响,有机物燃烧产物含有一氧化碳,装置F中CuO的作用是用氧化铜可以氧化没有燃烧完全的CO,装置D中发生反应是过氧化氢在二氧化锰催化作用下分解生成水和氧气,反应的化学方程式2H2O2
| ||
故答案为:氧化没有燃烧完全的CO;2H2O2
| ||
(3)三聚氰胺中含有碳、氢、氮三种元素,其相对分子质量为126,2.52g即0.02mol三聚氰胺样品氧化成CO2、H2O和N2,A、B两装置分别测定的是二氧化碳、水的质量,所以二氧化碳质量是2.64g,所以碳原子数目是3,即0.06mol,水的质量是1.08g,即0.06mol,所以氢原子个数是6,根据分子相对分子质量式126,所以氮原子数是3,即分子式为C3H6N6,故答案为:C3H6N6;
(4)为了保证测得二氧化碳中的碳元素全部来自有机物,所以要避开空气中二氧化碳的干扰,还缺少尾部缺少一个干燥装置,
故答案为:尾部缺少一个干燥装置,空气中的水蒸气和CO2进入A装置,影响CO2测定值.
点评:本题是一道有机化合物分子式的确定题,主要是物质成分的定量分析判断,化学式计算应用,考查学生分析和解决问题的能力,难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
下列分散系属于最稳定分散系的是( )
| A、NaOH(aq) |
| B、Ca(OH)2悬浊液 |
| C、Fe(OH)3胶体 |
| D、空气 |
雌黄(As2S3)是提取砷的主要矿物原料,雌黄和HNO3能发生如下反应:As2S3+10H++10NO
═2H3AsO4+3S+10NO2↑+2H2O.下列说法正确的是( )
- 3 |
| A、上述反应中As2S3发生还原反应,作还原剂 |
| B、该反应的氧化产物为H3AsO4和S |
| C、该反应可以说明HNO3的酸性强于H3AsO4的酸性 |
| D、若生成2mol H3AsO4,则反应中转移电子的物质的量为4 mol |
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
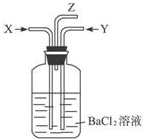
①洗气瓶中产生的沉淀是碳酸钡
②在Z导管出来的气体中无二氧化碳
③洗气瓶中产生的沉淀是硫酸钡
④在Z导管口有红棕色气体出现.

①洗气瓶中产生的沉淀是碳酸钡
②在Z导管出来的气体中无二氧化碳
③洗气瓶中产生的沉淀是硫酸钡
④在Z导管口有红棕色气体出现.
| A、①④ | B、①② | C、②③ | D、③④ |
为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将20样品加热,其质量变为13.8g,则该样品的纯度(质量分数)是( )
| A、84% | B、16% |
| C、69% | D、31% |


