题目内容
NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控.
Ⅰ.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为 .
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示.
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是 (填选项编号).
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是 (填化学方程式)
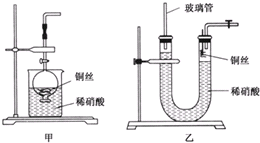
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO.反就开始后,可以在U形管右端观察到无色的NO气体.
①长玻璃管的作用是 .
②让反应停止的操作方法及原因是 .
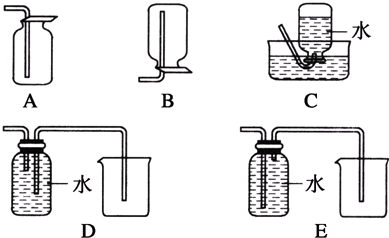
(4)以下收集NO气体的装置,合理的是 (填选项代号).
(5)假设实验中12.8g Cu全部溶解,需要通入标况下 mL O2才能使NO全部溶于水.
Ⅱ.用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是 (填“甲”、“乙”、“丙”或“丁”),理由是 .
甲:铜
硝酸铜
乙:铜
硝酸铜
丙:铜
氯化铜
硝酸铜
丁:铜
氧化铜
硝酸铜.
Ⅰ.(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示.
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是

(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO.反就开始后,可以在U形管右端观察到无色的NO气体.
①长玻璃管的作用是
②让反应停止的操作方法及原因是
(4)以下收集NO气体的装置,合理的是

(5)假设实验中12.8g Cu全部溶解,需要通入标况下
Ⅱ.用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是
甲:铜
| 浓硝酸 |
乙:铜
| 稀硝酸 |
丙:铜
| 氯气 |
| 硝酸 |
丁:铜
| 空气 |
| 硝酸 |
考点:性质实验方案的设计,硝酸的化学性质
专题:实验题
分析:I.(1)Cu与硝酸反应生成硝酸铜、NO和水,以此书写离子反应;
(2)①根据试验的目的是证明金属铜和硝酸之间的反应,根据目的选择所用的材料;
②图1中试管内有空气,NO被氧化为红棕色的气体;
(3)根据一氧化氮的溶解性和装置的特点解答;
(4)根据一氧化氮的溶解性与氧气的反应确定收集方法;
(5)根据得失电子守恒解答,1个铜原子失去2个电子,1个氧分子得到4个电子变成-2价的氧;
II.从经济角度出发,制取等量的硝酸铜时,所用的原料最少,成本最低;从环境保护的角度出发,制取硝酸铜时不对环境造成污染.
(2)①根据试验的目的是证明金属铜和硝酸之间的反应,根据目的选择所用的材料;
②图1中试管内有空气,NO被氧化为红棕色的气体;
(3)根据一氧化氮的溶解性和装置的特点解答;
(4)根据一氧化氮的溶解性与氧气的反应确定收集方法;
(5)根据得失电子守恒解答,1个铜原子失去2个电子,1个氧分子得到4个电子变成-2价的氧;
II.从经济角度出发,制取等量的硝酸铜时,所用的原料最少,成本最低;从环境保护的角度出发,制取硝酸铜时不对环境造成污染.
解答:
解:I.(1)金属铜可以和稀硝酸之间反应生成硝酸铜、一氧化氮以及水,即3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑,
故答案为:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑;
(2)①实验室若没有铜丝,铜粒以代替铜丝进行实验,则包裹桶里的不能是金属铁以及金属铝,因为他们的活泼性强于金属铜,会先于金属铜和硝酸之间发生反应,
故答案为:C、D;
②试管内有空气,NO容易被氧化为红棕色的气体二氧化氮,即2NO+O2═2NO2,故答案为:2NO+O2═2NO2;
(3)①一氧化氮是难溶于水的气体,当取一氧化氮的装置产生一氧化氮气体时,气体难溶于水,气体把U形管的液体压出,故答案为:接收被气体压出U形管的液体,防止稀硝酸溢出;
②让反应停止,则应该使铜和稀硝酸分开,具体操作方法及原因是关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止,故答案为:关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止;
(4)由于一氧化氮与氧气在常温下反应生成二氧化氮,故不能用排空法收集,所以只能用排水法,故C正确,而D和E排水法收集装置,应该短进长出,所以D正确,E错误,故选:CD;
(5)铜和硝酸反应,铜失去电子,硝酸得到电子变成一氧化氮,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,一氧化氮和氧气和水反应生成硝酸,4NO+2H2O+3O2=4HNO3,氧气得电子,一氧化氮失去电子,所以铜失去的电子数等于氧气得到的电子数,12.8g Cu为 0.2mol,全部溶解,失去0.4mol电子,1个氧分子得到4个电子变成-2价的氧,所以需氧气0.1mol,0.1mol氧气在标准状况下的体积为2240mL,
故答案为:2240mL;
II.甲:铜与浓硝酸制取硝酸铜时的方程式是:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成的NO2会造成大气污染,不环保,故甲不正确;
乙:铜与稀硝酸制取硝酸铜时的方程式是:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,生成的NO也会造成大气污染,不环保,故乙不正确;
丙:此过程中使用到了氯气,氯气剧毒,对环保不利,且氯化铜不能与硝酸反应生成硝酸铜,故丙不正确;
丁:此过程用方程式可表示为:2Cu+O2
2CuO,CuO+2HNO3=Cu(NO3)2+H2O,从过程可以看出该过程不会产生有毒气体,环保且没有多消耗原料,故丁正确;
故答案为:丁;制取相同质量的Cu(NO3)2,丁所消耗的HNO3的量最少(原料的利用率最高)且不产生污染环境的气体;
故答案为:3Cu+8H++2NO3-═3Cu2++4H2O+2NO↑;
(2)①实验室若没有铜丝,铜粒以代替铜丝进行实验,则包裹桶里的不能是金属铁以及金属铝,因为他们的活泼性强于金属铜,会先于金属铜和硝酸之间发生反应,
故答案为:C、D;
②试管内有空气,NO容易被氧化为红棕色的气体二氧化氮,即2NO+O2═2NO2,故答案为:2NO+O2═2NO2;
(3)①一氧化氮是难溶于水的气体,当取一氧化氮的装置产生一氧化氮气体时,气体难溶于水,气体把U形管的液体压出,故答案为:接收被气体压出U形管的液体,防止稀硝酸溢出;
②让反应停止,则应该使铜和稀硝酸分开,具体操作方法及原因是关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止,故答案为:关闭U形管右端导气管上的活塞,反应产生的气体将U形管右端内的稀硝酸向下压,使铜丝与稀硝酸分开,反应就会停止;
(4)由于一氧化氮与氧气在常温下反应生成二氧化氮,故不能用排空法收集,所以只能用排水法,故C正确,而D和E排水法收集装置,应该短进长出,所以D正确,E错误,故选:CD;
(5)铜和硝酸反应,铜失去电子,硝酸得到电子变成一氧化氮,3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,一氧化氮和氧气和水反应生成硝酸,4NO+2H2O+3O2=4HNO3,氧气得电子,一氧化氮失去电子,所以铜失去的电子数等于氧气得到的电子数,12.8g Cu为 0.2mol,全部溶解,失去0.4mol电子,1个氧分子得到4个电子变成-2价的氧,所以需氧气0.1mol,0.1mol氧气在标准状况下的体积为2240mL,
故答案为:2240mL;
II.甲:铜与浓硝酸制取硝酸铜时的方程式是:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,生成的NO2会造成大气污染,不环保,故甲不正确;
乙:铜与稀硝酸制取硝酸铜时的方程式是:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,生成的NO也会造成大气污染,不环保,故乙不正确;
丙:此过程中使用到了氯气,氯气剧毒,对环保不利,且氯化铜不能与硝酸反应生成硝酸铜,故丙不正确;
丁:此过程用方程式可表示为:2Cu+O2
| ||
故答案为:丁;制取相同质量的Cu(NO3)2,丁所消耗的HNO3的量最少(原料的利用率最高)且不产生污染环境的气体;
点评:本题考查了铜与硝酸的反应,掌握相关的化学反应方程式是解答本题的关键,注意NO易被氧化及NO对环境的污染,题目难度中等.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目
下列的离子方程式正确的是( )
| A、用大理石跟稀盐酸制二氧化碳:CO32-+2H+═H2O+CO2↑ |
| B、Cu丝伸入到AgNO3溶液中:Cu+Ag+═Cu2++Ag |
| C、H2SO4溶液中滴入Ba(OH)2溶液:OH-+H+═H2O |
| D、氧化镁与盐酸混合:MgO+2H+=Mg2++H2O |
据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以42He的形式存在.下列说法正确的是( )
| A、42He原子核内含有4个质子 |
| B、32He和42He互为同位素 |
| C、32He原子核内含有3个中子 |
| D、42He容易失去最外层的2电子 |
下列实验事实不能证明醋酸是弱酸的是( )
| A、常温下,含有石蕊的醋酸溶液加热颜色变深 |
| B、常温下,测得0.1 mol/L醋酸溶液的pH=4 |
| C、常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4 |
| D、常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和 |
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.